Lítio: Propriedades e usos do elemento
Entendendo o elemento lítio
O que é lítio?
O lítio, de número atômico 3 e símbolo Li, é o metal mais leve da tabela periódica e um metal alcalino. Durante os dois séculos de sua existência como uma curiosidade de laboratório, o lítio evoluiu para uma commodity industrial comercializada globalmente. Hoje, o refino e a produção de lítio - por meio da eletrólise do sal ou da moagem de minerais como o espodumênio - são a base de um setor multibilionário de armazenamento de energia, exploração espacial e eletrônica.

Descrição das propriedades químicas
As propriedades químicas dolítio refletem suas propriedades físicas, sendo igualmente distintas:
-Reatividade: O lítio reage vigorosamente com a água para formar hidróxido de lítio (LiOH) e gás hidrogênio. Por exemplo, um pedaço de lítio pequeno submerso em água pode desenvolver efervescência visível em segundos.
-Natureza alcalina: Por ser outro metal alcalino, o lítio cede prontamente seu único elétron externo para produzir o íon Li⁺, tornando-se, assim, um importante agente em reações eletroquímicas, inclusive em baterias de íons de lítio.
- Inflamabilidade: O lítio se inflama com uma chama vermelha característica, que os engenheiros devem ter em mente ao trabalhar e armazenar lítio a granel.
Tabela de dados de propriedades físicas
|
Propriedade |
Valor |
|
Número atômico |
3 |
|
Peso atômico |
6,94 g/mol |
|
Ponto de fusão |
180.54 °C |
|
Ponto de ebulição |
1590 °C |
|
Densidade |
0,534 g/cm³ |
|
Aparência |
Metal branco prateado |
|
Dureza |
Suave |
|
Condutividade elétrica |
Alta |
|
Condutividade térmica |
Alta |
Descoberta do lítio
O lítio foi descoberto pela primeira vez em 1817 na petalita, uma ilha de Utö, na Suécia. A análise de Arfvedson revelou um novo elemento não identificado com propriedades diferentes do sódio ou do potássio. Posteriormente, o lítio metálico foi separado por eletrólise de sais de lítio, para que cientistas e engenheiros pudessem analisar melhor suas propriedades físicas e químicas. Com o tempo, a estranha combinação de leveza, alta reatividade e potencial eletroquímico do lítio o colocou em uma trajetória que vai do armazenamento de energia a graxas industriais e medicamentos.
Ligas e compostos de lítio
- Ligas de lítio-alumínio: Extremamente leves e duras, usadas em componentes de aeronaves e peças de carros esportivos.
- Ligas de lítio-cobre: Proporcionam maior condutividade elétrica, sendo frequentemente usadas em conectores e circuitos eletrônicos.
- Fosfato de lítio-ferro (LiFePO₄): Comum em cátodos de baterias de carros elétricos devido à estabilidade e ao longo ciclo de vida.
- Hidróxido de lítio (LiOH) e carbonato (Li₂CO₃): De importância fundamental em baterias de recarga, graxa lubrificante e processos químicos industriais.
- Cloreto de lítio (LiCl): Usado em dessecantes, condicionadores de ar e síntese química.
Por exemplo, a Tesla e outros fabricantes de veículos elétricos utilizam baterias de fosfato de ferro-lítio (LFP) em determinadas frotas de carros, em que a estabilidade térmica e a densidade de energia são fundamentais para garantir a segurança e a funcionalidade.
Aplicações comuns
Há várias aplicações do lítio:
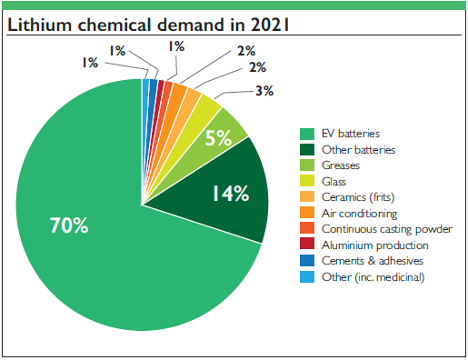
1. Baterias: As baterias de íon-lítio e de polímero de lítio dominam o mercado de eletrônicos portáteis, veículos elétricos e sistemas de armazenamento de energia renovável devido à sua alta densidade de energia.
2. Ligas metálicas: O lítio torna as ligas de alumínio e cobre mais leves, melhorando a eficiência aeroespacial sem perder a resistência.
3. Usos medicinais: O carbonato de lítio estabiliza pacientes com transtorno bipolar, mostrando o impacto do lítio além dos usos industriais.
4. Vidros e cerâmicas resistentes ao calor: O lítio aumenta a resistência a choques térmicos e a força.
5. Graxas lubrificantes: As graxas de lítio têm bom desempenho em altas temperaturas e pressões, essenciais nos setores de manufatura e automotivo.
 [1]
[1]
Processos de preparação
O lítio é obtido principalmente por meio de:
1. O lítio metálico é recuperado do LiCl ou LiF por meio de eletrólise para produzir alta pureza para aplicações de mercado.
2. Mineração de minerais: O espodumênio e a petalita são processados para formar carbonato ou hidróxido de lítio a ser usado na produção de baterias e produtos químicos.
Perguntas frequentes
Quais são as aplicações mais frequentes do lítio?
Principalmente em baterias recarregáveis, ligas leves, graxas lubrificantes e produtos farmacêuticos.
Como o lítio é extraído?
Por meio de eletrólise de sais de lítio ou de minérios de espodumênio.
O lítio é reativo?
Sim, principalmente com água, formando LiOH e gás hidrogênio.
O que são baterias de íons de lítio?
Elas fornecem energia para smartphones, laptops, veículos elétricos e sistemas de armazenamento de energia renovável devido à alta densidade de energia e ao longo ciclo de vida.
Referências:
[1] Associação Internacional de Lítio (2023, 13 de outubro). Lithium 101. Recuperado em 17 de julho de 2025, de https://lithium.org/lithium-101/

 Barras
Barras
 Miçangas e esferas
Miçangas e esferas
 Parafusos e porcas
Parafusos e porcas
 Cadinhos
Cadinhos
 Discos
Discos
 Fibras e tecidos
Fibras e tecidos
 Filmes
Filmes
 Flocos
Flocos
 Espumas
Espumas
 Folha de alumínio
Folha de alumínio
 Grânulos
Grânulos
 Favos de mel
Favos de mel
 Tinta
Tinta
 Laminado
Laminado
 Nódulos
Nódulos
 Malhas
Malhas
 Filme metalizado
Filme metalizado
 Placa
Placa
 Pós
Pós
 Vara
Vara
 Folhas
Folhas
 Cristais individuais
Cristais individuais
 Alvo de pulverização
Alvo de pulverização
 Tubos
Tubos
 Lavadora
Lavadora
 Fios
Fios
 Conversores e calculadoras
Conversores e calculadoras
 Escreva para nós
Escreva para nós




 Chin Trento
Chin Trento



