Melhores catalisadores de metais preciosos Pt, Pd e Au: Solução de gargalos de desempenho
Resumo
Os catalisadores de metais preciosos são essenciais para aumentar a eficiência dos processos químicos e de energia devido à sua excelente atividade intrínseca. No entanto, sua implantação prática é limitada por desafios persistentes relacionados à atividade, seletividade, estabilidade e custo. Esta análise aborda sistematicamente as principais limitações de desempenho de três importantes catalisadores de metais preciosos - Pt, Pd e Au - e examina as estratégias avançadas de design de materiais criadas para superar esses problemas. Especificamente, nos concentramos em:
1) Arquiteturas de liga e núcleo-casca em catalisadores à base de Pt para melhorar a atividade de redução de oxigênio e a durabilidade em células de combustível;
2) Configurações de um único átomo e de nanoclusters em sistemas baseados em Pd para obter seletividade superior e resistência à sinterização em reações de acoplamento cruzado; e
3) Projeto de suporte e controle de tamanho em catalisadores de Au para obter alta atividade na oxidação de CO em baixa temperatura.
Ao comparar as soluções personalizadas nesses três sistemas catalíticos, este trabalho tem como objetivo fornecer percepções interdisciplinares e orientar o projeto racional da próxima geração de catalisadores de metais preciosos de alto desempenho, duráveis e econômicos.

Fig. 1 Catalisadores de metais preciosos
1 Introdução
Os catalisadores de metais preciosos (como platina, paládio, ródio etc.) servem como materiais essenciais nas transições industriais e energéticas modernas, desempenhando um papel central nos setores de refino, síntese química, controle de emissões automotivas e energia de hidrogênio. Especialmente no contexto de uma mudança global em direção a estruturas de energia mais limpas, o rápido desenvolvimento das indústrias de células de combustível e hidrogênio de baixo carbono continua a impulsionar a demanda por metais do grupo da platina. As projeções do setor indicam que, até 2030, a capacidade global de produção de hidrogênio limpo deverá ultrapassar dez milhões de toneladas, solidificando ainda mais a importância estratégica dos catalisadores de metais preciosos na cadeia de suprimento de energia.
Entretanto, a adoção generalizada de catalisadores de metais preciosos ainda enfrenta vários desafios estruturais. A produção anual global de metais do grupo da platina é limitada e geograficamente concentrada, tornando as cadeias de suprimentos altamente vulneráveis às tensões geopolíticas e à volatilidade do mercado. Para reduzir a dependência de recursos externos, o aumento da eficiência da reciclagem de materiais essenciais se tornou uma estratégia prioritária para muitas nações. Atualmente, a recuperação de metais preciosos de catalisadores industriais usados se baseia principalmente em processos como pirólise, extração hidrometalúrgica e fundição pirometalúrgica. No entanto, esses métodos geralmente são caracterizados pelo alto consumo de energia e pelas taxas de recuperação comprometidas por impurezas. Em termos de inovação tecnológica, os pesquisadores estão desenvolvendo alternativas de metais não preciosos e sistemas de solventes ecológicos para reduzir a dependência de minerais virgens. Ao mesmo tempo, as regulamentações ambientais cada vez mais rigorosas estão impulsionando o estabelecimento de sistemas de gerenciamento que abrangem todo o ciclo de vida do catalisador - desde a produção e o uso até a regeneração -, levando o setor a equilibrar a eficiência dos recursos com a responsabilidade ambiental.
O projeto estrutural de precisão surgiu como um paradigma fundamental para superar os gargalos de desempenho em catalisadores de metais preciosos. Essa estratégia visa obter um controle sinérgico sobre as estruturas eletrônicas e geométricas dos locais ativos em escala atômica. Especificamente, as técnicas de modulação da estrutura eletrônica, como a liga e a engenharia de tensão, otimizam o comportamento de adsorção dos intermediários da reação, aumentando assim a atividade intrínseca. A engenharia geométrica, como a construção de átomos únicos, nanoclusters, planos de cristal específicos ou estruturas de núcleo-casca, maximiza a densidade e a estabilidade do local ativo. Enquanto isso, a engenharia da interface do portador e os efeitos de confinamento espacial permitem a orientação precisa do caminho da reação, superando assim os desafios do controle seletivo e da estabilidade de longo prazo. Este artigo explora sistematicamente as estratégias de projeto estrutural para três catalisadores representativos - Pt, Pd e Au - com base nesse conceito.

Fig. 2 Catalisadores de metais preciosos para combustão de gás
2 Problemas comuns e mecanismos de declínio de desempenho em catalisadores de metais preciosos
2.1 Deficiência do sítio ativo e baixa taxa de utilização
2.1.1 Adsorção de venenos e bloqueio de sítios ativos
As impurezas na alimentação da reação, como as espécies que contêm enxofre (por exemplo, H₂S, compostos organossulfurados) e cloro (por exemplo, íons cloreto, organoclorados), podem ser fortemente adsorvidas nos centros ativos das nanopartículas de metais nobres. Esse processo de quimissorção geralmente leva à formação de compostos de superfície estáveis, como sulfeto de ródio (Rh₂S₃) ou cloreto de ródio (RhCl₃), que ocupam e desativam permanentemente os locais catalíticos. Além disso, a deposição dessas impurezas no suporte do catalisador pode bloquear fisicamente os mesoporos e microporos dos materiais de carbono, dificultando assim a difusão das moléculas reagentes para os locais ativos.
2.1.2 Aglomeração de partículas metálicas e degradação do suporte
As nanopartículas de metais nobres (geralmente com tamanho de 2 a 10 nm) são suscetíveis à migração e à coalescência durante os ciclos de reação de alta temperatura, levando à formação de grandes aglomerados com mais de 50 nm. Esse fenômeno de sinterização pode reduzir a área de superfície eletroquimicamente ativa em mais de 75%. Ao mesmo tempo, o próprio suporte de carbono sofre degradação sob exposição prolongada a altas temperaturas, manifestando-se como decomposição térmica, formação de rachaduras e perda de resistência mecânica. Esse colapso estrutural do suporte acelera ainda mais a aglomeração de partículas metálicas e compromete a integridade geral da arquitetura do catalisador.
2.1.3 Dissolução e desprendimento induzidos por flutuações do processo
As instabilidades operacionais, especialmente quando o potencial redox do sistema de reação flutua além da janela de tolerância do catalisador (normalmente ±0,3 V), podem induzir a dissolução anódica do metal nobre em ambientes ácidos. Esse processo gera espécies iônicas solúveis, como Rh³⁺, levando à perda irreversível do metal. Paralelamente, a exposição prolongada a condições altamente ácidas ou alcalinas pode provocar a hidrólise ou a neutralização dos grupos funcionais na superfície do suporte de carbono, enfraquecendo a interação metal-suporte e resultando no desprendimento das partículas ativas.
2.1.4 Corrosão mediada por vapor e colapso de poros
Em sistemas que contêm vapor de água, a condensação e a permeação de vapor dentro dos nanoporos do suporte de carbono geram forças capilares e tensão interfacial. Essas tensões podem causar microfraturas e o colapso da estrutura dos poros. Simultaneamente, o vapor de água pode interagir com impurezas (por exemplo, Cl-, SO₄²-) para formar um eletrólito corrosivo localizado, que acelera a dissolução de nanopartículas metálicas e seu subsequente desprendimento do suporte comprometido.
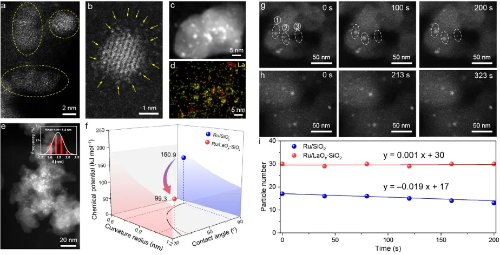
Fig. 3 Catalisadores de ilhas nanoestruturadas para neutralizar a sinterização de partículas
2.2 Sinterização e Ostwald Ripening de nanopartículas
A sinterização de nanopartículas metálicas suportadas representa uma causa fundamental da desativação em alta temperatura em catalisadores heterogêneos. O entendimento convencional postula que a sinterização ocorre principalmente por meio de dois mecanismos mediados pelo substrato: Amadurecimento de Ostwald e migração e coalescência de partículas. Embora técnicas avançadas in-situ, como a microscopia eletrônica de transmissão ambiental, tenham validado esses caminhos em condições de pressão quase ambiente, os mecanismos de evolução dinâmica das nanopartículas sob condições industriais extremas de alta temperatura e alta pressão permanecem inadequadamente compreendidos.
Pesquisas recentes empregando simulações cinéticas reativas de Monte Carlo combinadas com cálculos da teoria do funcional da densidade revelaram um mecanismo de coalescência e salto de partículas (PHC) não reconhecido anteriormente sob alta pressão de CO e temperatura elevada. Esse processo envolve nanopartículas de Au que se desprendem do suporte de TiO₂(101) anatase, passam por "saltos aéreos" por meio de migração em fase gasosa e coalescem com outras partículas. Quando os aglomerados coalescidos ultrapassam um tamanho crítico, eles se depositam novamente na superfície do suporte. Esse comportamento é impulsionado pela forte interação entre as moléculas de CO e os átomos de Au interfaciais sob alto potencial químico de CO, que excede a energia de ligação entre a nanopartícula e o suporte.
Esse mecanismo não apenas elucida os caminhos de desativação rápida dos catalisadores em condições de trabalho realistas, mas também implica que a sinterização de nanopartículas e a migração entre suportes podem ocorrer com muito mais frequência e dinamicamente do que se supunha anteriormente. As descobertas oferecem uma nova perspectiva teórica para a compreensão da perda de estabilidade térmica em catalisadores industriais e estabelecem uma estrutura metodológica para a simulação de sistemas em nanoescala em escalas espaciais e temporais acopladas.

Fig. 4 Maturação de Ostwald
2.3 Envenenamento de catalisadores de metais preciosos
O envenenamento de catalisadores de metais preciosos refere-se ao fenômeno em que traços de impurezas no sistema de reação ocupam ou degradam irreversivelmente os locais ativos por meio de quimissorção ou reações químicas, levando a um declínio significativo na atividade e na seletividade do catalisador. Ela representa uma das principais causas de desativação em catalisadores industriais.
2.3.1 Mecanismos e tipos de envenenamento
Com base na natureza da interação entre o veneno e os locais ativos, o envenenamento é normalmente categorizado em dois tipos:
A) Envenenamento químico: O veneno interage fortemente com os locais ativos por meio de forças químicas. Essa é a forma mais comum de envenenamento.
- Envenenamento por forte quimissorção: As moléculas de veneno sofrem quimissorção irreversível ou fortemente reversível nos sítios ativos, com energias de adsorção muito mais altas do que as dos reagentes-alvo, bloqueando fisicamente os sítios. Por exemplo, os compostos contendo enxofre, fósforo e cianeto apresentam capacidades de adsorção muito fortes em muitas superfícies metálicas.
- Envenenamento por efeitos eletrônicos: O veneno altera a estrutura eletrônica (por exemplo, o centro da banda d) dos centros ativos de metais preciosos doando ou retirando elétrons, consequentemente alterando sua capacidade de adsorção de reagentes e impedindo a reação catalítica.
- Envenenamento por efeitos estruturais: Certos venenos podem induzir o rearranjo dos átomos da superfície, interrompendo a estrutura geométrica original dos centros ativos.
B) Envenenamento físico/incrustação: O veneno em si pode não interagir quimicamente com os locais ativos, mas se deposita fisicamente sobre os locais ativos ou nas bocas dos poros do suporte, dificultando a transferência de massa dos reagentes.
2.3.2 Venenos comuns e seus mecanismos
Diferentes metais preciosos apresentam sensibilidades variadas a diferentes venenos. A tabela abaixo lista os venenos típicos e seus efeitos:
Tabela 1 Venenos típicos
|
Categoria do veneno |
Substâncias representativas |
Catalisadores mais afetados |
Breve descrição do mecanismo |
|
Compostos contendo enxofre |
H₂S, COS, SO₂, Mercaptanos, Tiofeno |
Pt, Pd, Rh, Ru |
Os átomos de S possuem pares de elétrons solitários, permitindo uma coordenação altamente eficaz com os orbitais d de metais preciosos, formando ligações M-S estáveis. Eles estão entre os venenos mais comuns e potentes. |
|
Compostos que contêm halogênio |
Cl-, HCl, organoclorados |
Pt, Pd |
Os íons ou átomos de halogênio são altamente eletronegativos e se adsorvem fortemente em superfícies metálicas, alterando o desempenho catalítico por meio de efeitos eletrônicos. Às vezes, eles podem causar perda de metal pela formação de haletos voláteis. |
|
Compostos de metais pesados |
Compostos de Pb, Hg, As, Bi, Sn |
A maioria dos catalisadores de metais preciosos |
Esses metais ou seus íons têm baixos potenciais de deposição em superfícies de metais preciosos e podem cobrir permanentemente os locais ativos por meio de deslocamento irreversível de metal ou reações de liga. |
|
Compostos contendo fósforo/nitrogênio |
PH₃, Fosfinas, Aminas, Cianetos |
Ni, Pd, Pt |
Semelhante aos compostos que contêm S, os átomos de P e N têm forte capacidade de coordenação e podem formar ligações de coordenação estáveis com centros ativos. |
|
Hidrocarbonetos insaturados / Coque |
Alcenos, alcinos, precursores de coque |
A maioria dos catalisadores metálicos |
Passam por reações de polimerização e desidrogenação em altas temperaturas, formando depósitos carbonáceos de alto peso molecular que cobrem fisicamente os locais ativos e os poros. |
2.3.3 Fatores que influenciam o grau de envenenamento
Natureza do veneno: A força de adsorção, o impedimento estérico e os efeitos eletrônicos da molécula de veneno com o local ativo.
Propriedades do catalisador: A estrutura eletrônica de diferentes metais preciosos determina sua resistência ao envenenamento; por exemplo, a Pt é sensível ao CO, enquanto a Pd é sensível ao S. As propriedades do suporte também influenciam a difusão e a adsorção de venenos.
Condições do processo: Temperatura, pressão, concentração de reagentes, etc. Por exemplo, a alta temperatura pode dessorver certos venenos, mas também pode acelerar a coqueificação; uma atmosfera redutora pode inibir a adsorção de certos venenos oxidantes (por exemplo, SO₂).
2.4 Dissolução e lixiviação de metais
A dissolução e a lixiviação de metais representam uma via de degradação crítica na eletrocatálise, afetando particularmente os catalisadores à base de platina e paládio em condições operacionais. O mecanismo de dissolução eletroquímica envolve processos complexos dependentes do potencial em que os átomos de metais nobres se oxidam em espécies iônicas solúveis. Por exemplo, a platina sofre oxidação sequencial para formar íons Pt²⁺ e Pt⁴⁺ que migram para o eletrólito, seguindo um caminho dinâmico de dissolução-redeposição em que as espécies dissolvidas se redepositam preferencialmente em partículas maiores ou em regiões mais catódicas. Esse fenômeno é significativamente acelerado em condições de ciclo potencial, com as taxas de dissolução sendo fortemente influenciadas por parâmetros operacionais, incluindo janelas de potencial, temperatura, pH e taxas de varredura.
Os defeitos estruturais servem como locais de início primário para a dissolução, onde cantos, bordas e locais de deslocamento demonstram maior suscetibilidade ao ataque oxidativo. Estudos avançados in situ revelam que as nanoestruturas núcleo-casca, como os nanocubos de Pd@Pt, sofrem degradação exacerbada por meio de corrosão galvânica e mecanismos de corrosão induzidos por haletos, começando pela interface núcleo-casca e se propagando para fora. Ao mesmo tempo, a corrosão do material de suporte, especialmente a degradação do suporte de carbono sob altos potenciais e temperaturas, exacerba ainda mais a perda de metal ao enfraquecer a ancoragem das partículas.
As estratégias de atenuação se concentram no aumento da estabilidade termodinâmica dos átomos de metal por meio da modulação da estrutura eletrônica. A liga de platina com elementos mais nobres, como o ouro, demonstra uma eficácia notável, em que a incorporação de Au eleva o potencial de início da dissolução e reduz as taxas de dissolução em aproximadamente 40% por meio da doação de elétrons que aumenta a nobreza da platina. As arquiteturas de núcleo-casca que utilizam materiais de núcleo mais baratos (por exemplo, Pd) diminuem simultaneamente o uso de metais preciosos e introduzem tensão compressiva para aumentar a estabilidade da casca. Como alternativa, a dispersão em escala atômica por meio de catalisadores de um único átomo ancorados em suportes modificados (por exemplo, Pt em CeO₂ dopado com Zr) alcança uma estabilidade excepcional, mantendo a integridade estrutural mesmo sob condições hidrotérmicas severas a 800 °C, evitando a migração e a sinterização de partículas.
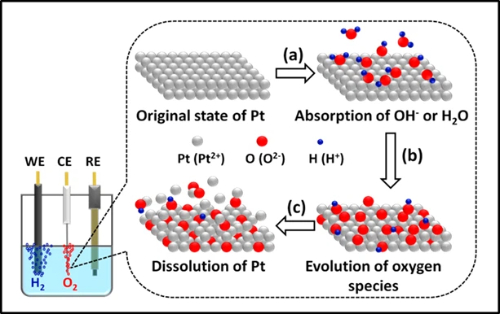
Fig. 5 Fenômeno de dissolução da platina no processo eletroquímico de divisão da água para produção de hidrogênio
2.5 Perda do controle de seletividade
O controle preciso das vias de reação representa um desafio fundamental em reações complexas de várias etapas, nas quais os catalisadores à base de paládio frequentemente apresentam seletividade comprometida devido à energia de adsorção intermediária não otimizada. O mecanismo subjacente que rege a seletividade está na estrutura eletrônica dos locais ativos, especialmente na posição central da banda d, que determina as forças de adsorção de reagentes e intermediários. Na redução eletroquímica de nitrilas a aminas primárias, os catalisadores convencionais de Pd demonstram força de adsorção excessiva em relação aos intermediários *CH₃CN, promovendo caminhos indesejados de redução profunda e reações colaterais de evolução de hidrogênio que, coletivamente, diminuem a eficiência Faradaica em relação aos produtos-alvo.
As estratégias avançadas de projeto de catalisadores abordam com sucesso essas limitações por meio da manipulação precisa das estruturas eletrônicas e geométricas da superfície. A engenharia de deformação da rede exemplifica essa abordagem, em que os aeros de metaleno Pd@Pd-Cu alcançam uma notável seletividade de etilamina de 95,38% por meio da introdução de deformação compressiva controlada que ajusta de forma ideal a posição central da banda d e a força de adsorção intermediária. A incorporação de cobre gera superfícies de paládio precisamente deformadas que equilibram a ativação *CH₃CN e a estabilização intermediária *CH₃CH=NH, suprimindo com eficácia as vias concorrentes.
Outras inovações surgem dos princípios de design de alta entropia, em que o metaleno de alta entropia PdRhFeCoMo rompe a simetria convencional do local por meio da desordem configuracional. Esse "efeito coquetel" cria ambientes de coordenação local exclusivos que aumentam significativamente a adsorção de etanol e a capacidade de clivagem da ligação C-C, alcançando uma seletividade sem precedentes da via C1 de 84,12% na oxidação do etanol e, ao mesmo tempo, melhorando a resistência ao envenenamento por meio do comportamento modificado do hidrogênio na superfície.
A sinergia bimetálica fornece dimensões adicionais para a otimização da seletividade, conforme demonstrado pelos aeros de metaleno Pt-Pd, em que a incorporação da platina modula o centro da banda d do paládio para criar catalisadores de função dupla capazes de promover simultaneamente a oxidação anódica do etanol e a evolução catódica do hidrogênio. Essa otimização da estrutura eletrônica equilibra a energia de adsorção para diferentes intermediários em várias reações, permitindo processos em cascata eficientes.
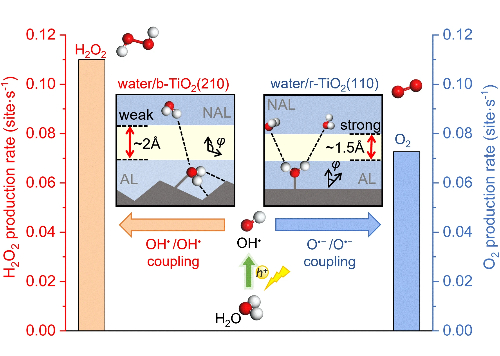
Fig. 6 Controle seletivo da oxidação fotocatalítica da água
3 Três soluções específicas de materiais
3.1 Abordagem para soluções de catalisadores à base de platina
Os catalisadores à base de platina (Pt) são essenciais para a reação de redução de oxigênio (ORR) no cátodo das células de combustível de membrana de troca de prótons (PEMFCs), mas sua comercialização generalizada continua a ser dificultada por três desafios fundamentais: cinética lenta da ORR, alto custo devido à escassez de Pt e degradação estrutural - incluindo dissolução, migração e sinterização de nanopartículas de Pt - sob condições operacionais dinâmicas, como ciclo potencial e alta tensão. Para lidar com essas limitações, foram desenvolvidas estratégias avançadas de design de materiais, principalmente centradas nas três abordagens a seguir.

Fig. 7 Melhorando a estabilidade dos catalisadores à base de platina para células de combustível
Solução 1: Ligas de Pt-M e estruturas Core-Shell
Essa abordagem envolve a adaptação da estrutura eletrônica da Pt por meio da introdução de metais de transição (M), o que aumenta a atividade catalítica e a durabilidade, ao mesmo tempo em que reduz a carga de Pt.
Descrição da estratégia:
Nanopartículas de liga à base de Pt - incorporando metais de transição, como Ni, Co, Fe ou Cu - são sintetizadas por meio de métodos de substituição galvânica ou química úmida. Como alternativa, são construídas arquiteturas de núcleo-casca (por exemplo, Pd@Pt) ou estruturas de Pt-pele, em que uma casca rica em Pt envolve um material de núcleo mais acessível, como Pd ou um metal não nobre.
Mecanismo de ação:
Efeito eletrônico (ligante): A transferência de elétrons de metais de transição para a Pt reduz o centro da banda d da Pt, otimizando a energia de adsorção de intermediários contendo oxigênio (por exemplo, O e OH) e, assim, acelerando a cinética da ORR. Por exemplo, a superfície Pt3Ni(111) apresenta uma atividade de ORR dez vezes maior do que a Pt(111).
Efeito geométrico (deformação): A incompatibilidade de rede entre o núcleo e o invólucro de Pt induz a tensão compressiva, que ajusta ainda mais a estrutura eletrônica da Pt e aprimora seu desempenho catalítico.
Benefício econômico:
Ao concentrar a Pt na camada superficial, as estruturas núcleo-casca maximizam a eficiência da utilização da Pt, reduzindo significativamente o custo geral do catalisador.
Solução 2: controle de morfologia e exposição de facetas de alto índice
Essa estratégia se concentra na modelagem de nanocristais de Pt para expor facetas de cristal altamente ativas, melhorando a atividade de massa sem alterar a composição química.
Descrição da estratégia:
Usando técnicas de síntese coloidal com surfactantes e cinética de redução cuidadosamente controlados, são produzidas nanoestruturas de Pt bem definidas, como nanocubos (facetas {100}), octaedros (facetas {111}) e estruturas dendríticas.
Mecanismo de ação:
Facetas de alta atividade: as facetas de alto índice (por exemplo, {730}, {510}) possuem uma alta densidade de átomos de degrau e de dobra, que servem como locais ativos altamente insaturados. Esses locais facilitam a clivagem da ligação O-O e a dessorção intermediária, levando a uma atividade ORR intrínseca superior.
Integridade estrutural: Certas arquiteturas, como nanoestruturas e nanoestruturas ramificadas, fornecem estruturas robustas que resistem à migração e à coalescência de partículas, melhorando assim a estabilidade catalítica.
Solução 3: suportes estáveis e forte interação metal-suporte
Essa abordagem visa a atenuar a corrosão do suporte de carbono - uma das principais causas do desprendimento e da degradação das nanopartículas de Pt - empregando materiais de suporte robustos e funcionalizados.
Descrição da estratégia:
Os suportes de carbono convencionais são substituídos por materiais avançados, incluindo:
Carbonos grafíticos (por exemplo, grafeno, nanotubos de carbono), conhecidos por sua alta condutividade elétrica e resistência à corrosão;
Carbonos dopados com heteroátomos (por exemplo, dopados com N, B e P), que aumentam a interação metal-suporte e modificam as propriedades eletrônicas;
Óxidos/carbetos metálicos (por exemplo, TiO2, SnO2, TiC), que oferecem excelente estabilidade em condições de oxidação.
Mecanismo de ação:
Forte interação metal-suporte (SMSI): Grupos funcionais ou defeitos na superfície do suporte formam fortes ligações covalentes (por exemplo, Pt-O-Ti) com nanopartículas de Pt, suprimindo com eficácia a migração de partículas, o amadurecimento de Ostwald e o desprendimento.
Maior durabilidade: A estabilidade eletroquímica superior desses suportes em condições de alto potencial minimiza a perda de Pt induzida por corrosão, aumentando assim a vida útil do catalisador.
Tabela 1 Gráfico comparativo de soluções de catalisador à base de platina
|
Soluções |
Estratégias principais |
Mecanismos para aumentar a atividade |
Mecanismos para aumentar a estabilidade |
Custo-efetividade |
Principais desafios |
|
Ligas de Pt-M e estruturas núcleo-casca |
Regulamentação da composição e da estrutura |
Os efeitos do ligante e os efeitos da deformação otimizam conjuntamente os centros da banda d da Pt, diminuindo a barreira de energia da ORR. |
Elementos de liga ou camadas centrais aumentam o potencial de dissolução da Pt por meio de efeitos de suporte; certos elementos de liga (por exemplo, Ni) formam estruturas de pele de Pt após a dissolução, melhorando a estabilidade da superfície. |
Alta (reduz significativamente o consumo de Pt) |
Os metais de transição podem ser lixiviados em ambientes ácidos, levando à deterioração da atividade e à incrustação da membrana; os processos de fabricação da estrutura core-shell são complexos. |
|
Controle de morfologia e planos cristalinos de alto índice |
Engenharia de superfície |
A exposição de planos de cristal de alto índice com átomos de coordenação insaturados de alta densidade fornece locais ativos altamente intrínsecos. |
Estruturas interconectadas com morfologias específicas (por exemplo, dendritos, nanoframes) suprimem a migração de partículas. |
Moderado (alta utilização de Pt, mas custo de síntese relativamente alto) |
Os planos cristalinos de alto índice são normalmente instáveis sob condições de reação e se reconstroem prontamente em planos de baixa energia; existem desafios para alcançar síntese e reprodutibilidade escalonáveis. |
|
Suportes estáveis com fortes interações metal-suporte |
Engenharia de suporte |
Suportes de carbono dopados podem modular a estrutura eletrônica da Pt por meio de efeitos eletrônicos; melhoram a transferência de massa. |
Interações fortes ancoram as partículas de Pt; suportes altamente estáveis resistem à corrosão e evitam o desprendimento de partículas. |
Moderado (o custo do transportador pode aumentar, mas prolonga a vida útil) |
Alguns suportes altamente estáveis (por exemplo, óxidos metálicos) apresentam baixa condutividade, aumentando potencialmente a resistência interfacial; é necessário um controle preciso dos mecanismos de interação metal-porte. |
3.2 Soluções de catalisadores à base de paládio
Os catalisadores à base de paládio (Pd) são fundamentais na síntese de química fina, principalmente nas reações de acoplamento cruzado e hidrogenação/oxidação seletiva. No entanto, sua implementação prática tem sido persistentemente limitada por três grandes desafios: a dificuldade de recuperar e reutilizar catalisadores homogêneos de Pd, apesar de sua alta seletividade; os locais ativos não uniformes em catalisadores heterogêneos de Pd, levando a problemas como lixiviação e desativação induzida por sinterização; e a dificuldade significativa de obter um controle preciso sobre a seletividade química, regio e estereosseletividade. Para abordar simultaneamente a atividade, a estabilidade e a seletividade, foram desenvolvidas as seguintes estratégias avançadas.
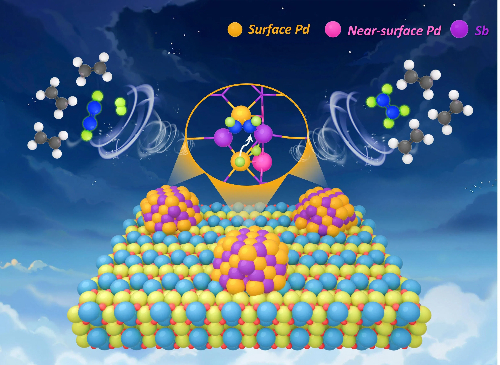
Fig. 8 Local de hidrogenação do catalisador à base de paládio para alcenos
Solução 1: Catalisadores de átomo único
Essa abordagem envolve a estabilização do Pd como átomos isolados para criar sítios ativos estruturalmente uniformes, oferecendo um caminho ideal para a máxima seletividade e eficiência atômica.
Descrição da estratégia:
Átomos individuais de Pd são ancorados em suportes ricos em defeitos, como óxidos metálicos (CeO2, TiO2), nitreto de carbono (g-C3N4) ou carbono dopado com nitrogênio (N-C), por meio de métodos que incluem forte adsorção eletrostática, co-precipitação ou pirólise em alta temperatura.
Mecanismo de ação:
Eficiência atômica maximizada e locais ativos uniformes: Cada átomo de Pd funciona como um local ativo independente e estruturalmente idêntico, alcançando uma utilização atômica quase teórica. Essa uniformidade elimina reações colaterais causadas por sítios ativos heterogêneos, permitindo uma seletividade excepcionalmente alta do produto-alvo.
Estabilidade aprimorada: As fortes interações covalentes entre os átomos de Pd e os heteroátomos (por exemplo, O, N) na superfície do suporte imobilizam efetivamente as espécies de Pd, suprimindo a migração, a aglomeração e a lixiviação, melhorando, assim, a durabilidade catalítica em vários ciclos.
Solução 2: Nanoclusters e catálise de confinamento
Essa estratégia se concentra no controle preciso do número de átomos de Pd e na exploração do confinamento espacial para adaptar o comportamento catalítico na escala subnanométrica, permitindo a seletividade em nível molecular.
Descrição da estratégia:
Os clusters de Pd com nuclearidade bem definida (por exemplo, Pd4, Pd8) são sintetizados usando métodos coloidais ou químicos precisos. Como alternativa, as espécies de Pd são encapsuladas nas estruturas porosas ordenadas de zeólitas ou estruturas metal-orgânicas (MOFs) por meio da síntese ship-in-a-bottle.
Mecanismo de ação:
Efeitos de tamanho quântico: Na escala de aglomerado subnanométrico, o Pd apresenta estruturas eletrônicas discretas que diferem tanto dos átomos individuais quanto das nanopartículas maiores, levando a propriedades catalíticas exclusivas e à ativação de vias de reação específicas.
Confinamento espacial e catálise seletiva de forma: Os ambientes de poros confinados de zeólitas ou MOFs atuam como nanorreatores, que:
Admitem seletivamente reagentes e liberam produtos com base no tamanho e na forma molecular (seletividade de tamanho),
Restringem as geometrias do estado de transição para controlar a estereoquímica da reação (estereosseletividade),
Isolar fisicamente os clusters de Pd para evitar a agregação e o crescimento.
Solução 3: Formação in situ de nanopartículas de Pd na fase líquida
Essa abordagem aproveita um sistema catalítico dinâmico em que as espécies ativas de Pd são geradas in situ, combinando o alto desempenho da catálise homogênea com a recuperação fácil da catálise heterogênea.
Descrição da estratégia:
Precursores de Pd solúveis (por exemplo, Pd(OAc)2) ou complexos estabilizados por ligantes são introduzidos na mistura de reação, onde são reduzidos in situ sob condições de reação para formar nanopartículas ou nanoclusters de Pd altamente ativos no suporte ou no meio líquido.
Mecanismo de ação:
Sinergia entre catálise homogênea e heterogênea: As nanopartículas de Pd formadas in situ são pequenas, defeituosas e altamente ativas, assemelhando-se a catalisadores homogêneos em termos de desempenho. Após a reação, essas espécies podem ser transformadas em formas menos ativas ou insolúveis (por exemplo, por meio de oxidação ou aglomeração), permitindo a separação e a reciclagem simples, semelhante aos sistemas heterogêneos.
Mitigação da desativação: Esse processo dinâmico resolve a troca entre estabilidade e atividade: pequenas partículas altamente ativas se formam durante a reação, enquanto um estado mais estável é adotado após a reação, minimizando a sinterização irreversível e a desativação durante a reutilização.
Tabela 2 Tabela de comparação horizontal de soluções de catalisador à base de paládio
|
Solução |
Estratégia principal |
Seletividade Força |
Mecanismo de estabilidade |
Utilização de átomos |
Cenários aplicáveis |
|
Catalisadores de átomo único |
Dispersão atômica e homogeneização estrutural |
Química e estereosseletividade |
Forte ligação metal-suporte |
~100% |
Hidrogenação seletiva, oxidação de CO |
|
Nanoclusters e catálise confinada |
Nuclearidade precisa e confinamento espacial |
Tamanho e estereosseletividade |
O confinamento físico evita a aglomeração |
Alta |
Síntese quiral, reações seletivas de forma |
|
Formação in situ de nanopartículas de Pd |
Formação dinâmica de espécies ativas |
Seletividade química |
O equilíbrio dinâmico reduz a sinterização |
Alta durante a reação, requer reativação |
Síntese química fina reciclável |
3.3 Soluções de catalisadores à base de ouro
O ouro (Au), embora quimicamente inerte em sua forma bruta, demonstra uma atividade catalítica excepcional quando projetado em nanoescala e com suporte adequado - uma descoberta transformadora que remodelou a catálise moderna. A implantação prática de catalisadores à base de ouro, no entanto, enfrenta três grandes desafios: a inércia intrínseca do Au em massa; a forte tendência das nanopartículas de Au de se sinterizarem ou sofrerem amadurecimento de Ostwald sob condições de reação, levando à rápida desativação; e a sensibilidade à umidade e a determinadas espécies de envenenamento. Para superar essas limitações e liberar todo o potencial dos nanocatalisadores de Au, foram desenvolvidas várias estratégias avançadas de projeto, conforme descrito abaixo.
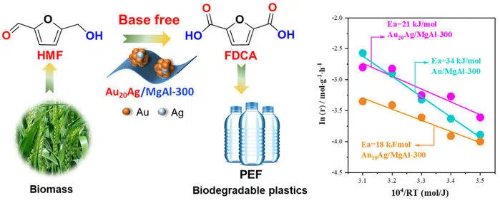
Fig. 9 Catalisadores à base de ouro para bioconversão
Solução 1: Controle de tamanho e engenharia de suporte
Essa abordagem aproveita os efeitos quânticos e as interações de suporte para ativar as nanopartículas de Au por meio do controle preciso de seu tamanho e estado de dispersão.
Descrição da estratégia:
Nanopartículas de ouro menores do que 5 nm (idealmente na faixa de 2 a 3 nm) são sintetizadas por meio de métodos como deposição-precipitação ou síntese coloidal e depositadas em suportes de óxido de metal redutíveis, incluindo TiO2, Fe2O3 e CeO2.
Mecanismo de ação:
Efeitos de tamanho quântico: À medida que o tamanho da partícula de Au diminui abaixo de ∼5 nm, sua estrutura eletrônica passa de metálica para não metálica, resultando em uma alta proporção de átomos de superfície subcoordenados (por exemplo, degraus, bordas). Esses locais exibem capacidades aprimoradas de adsorção e ativação de moléculas pequenas, como CO e O2, constituindo a origem fundamental da atividade catalítica do Au.
Ativação mediada por suporte: Certos suportes de óxido metálico não apenas estabilizam as nanopartículas de Au, mas também participam diretamente dos ciclos catalíticos. Por exemplo, na oxidação do CO por meio do mecanismo de Mars-van Krevelen, o oxigênio da rede do suporte (por exemplo, CeO2) reage com o CO, enquanto o O2 da fase gasosa reabastece as vacâncias de oxigênio, criando um ciclo catalítico sinérgico entre o Au e o suporte.
Solução 2: Interface Au-Suporte e locais bifuncionais
Essa estratégia se concentra no projeto deliberado de locais interfaciais entre as nanopartículas de Au e o suporte, onde ocorre a catálise sinérgica.
Descrição da estratégia:
Por meio do controle cuidadoso dos parâmetros de síntese, como a seleção da faceta do suporte, a temperatura de calcinação e a atmosfera, as nanopartículas de Au são finamente dispersas para maximizar a densidade e a estabilidade dos locais interfaciais Au-suporte.
Mecanismo de ação:
Catálise bifuncional interfacial: Em reações importantes, como a oxidação de CO em baixa temperatura, o sítio ativo geralmente está localizado no perímetro do suporte de Au. Aqui, o Au facilita a adsorção e a ativação do CO, enquanto o suporte adjacente ativa o O2 (ou H2O). Essa divisão espacial e funcional do trabalho reduz significativamente a barreira de ativação e aumenta as taxas de reação por meio da interação sinérgica.
Solução 3: Liga e modificação da superfície
Essa abordagem aumenta a atividade e a estabilidade dos catalisadores de Au, introduzindo um segundo modificador de metal ou óxido para adaptar as propriedades eletrônicas e estruturais.
Descrição da estratégia:
O Au é ligado a outros metais (por exemplo, Pd, Pt, Ag) ou modificado na superfície com óxidos metálicos (por exemplo, FeOx, TiOx) para formar nanopartículas de liga ou arquiteturas decoradas e de casca central.
Mecanismo de ação:
Modulação eletrônica: A introdução de um segundo elemento altera a densidade eletrônica dos átomos de Au por meio dos efeitos do ligante, ajustando a força de adsorção dos intermediários e expandindo o escopo da reação além do que o Au puro pode alcançar.
Estabilização estrutural: O componente secundário atua como um espaçador físico, inibindo o contato direto e a coalescência das partículas de Au durante o tratamento térmico ou a reação, melhorando, assim, a resistência à sinterização e a longevidade operacional.
Tabela 3 Tabela de comparação horizontal de soluções de catalisador à base de ouro
|
Soluções |
Estratégia principal |
Sítio ativo |
Mecanismo para aumentar a estabilidade |
Vantagens |
Principais desafios |
|
Efeito do tamanho e seleção do transportador |
Controle do tamanho da partícula (<5 nm) usando transportadores específicos |
Átomos de baixa coordenação na superfície de pequenas partículas de Au; locais de ativação que participam do transportador |
Os transportadores fornecem locais de ancoragem, suprimindo a migração de partículas |
Alta atividade intrínseca, diversas opções de transportadores e estudos aprofundados de mecanismos |
Instabilidade termodinâmica de partículas pequenas, propensas à sinterização; forte dependência das propriedades do transportador |
|
Construção da interface Au-Suporte |
Controle preciso da interface de contato entre o Au e o suporte |
Locais de dupla função na interface Au-Suporte |
Fortes interações metal-suporte estabilizam as partículas de Au |
Exploração total dos efeitos sinérgicos entre o ouro e o suporte, com locais ativos bem definidos |
A estrutura da interface pode se reconfigurar durante as reações, exigindo alta reprodutibilidade na preparação |
|
Liga e modificação da superfície |
Introdução de um segundo componente para regular as estruturas eletrônicas e geométricas |
Átomos de Au próximos a superfícies de ligas ou camadas modificadas |
O segundo componente atua como uma barreira física, impedindo que as partículas de Au entrem em contato com as camadas sinterizadas |
Aumenta simultaneamente a atividade e a estabilidade térmica com grande capacidade de ajuste |
Pode introduzir custo ou complexidade; o segundo componente pode segregar ou lixiviar |
4 Comparação abrangente e perspectivas
4.1 Comparação abrangente
Por meio de uma análise aprofundada dos três principais catalisadores de metais preciosos - platina (Pt), paládio (Pd) e ouro (Au) -, podemos resumir sistematicamente suas características e soluções, destilando princípios comuns de projeto e futuras direções de desenvolvimento.
Tabela 4 Comparação abrangente de três catalisadores de metais preciosos
|
Material |
Aplicação principal |
Problema principal |
Solução principal |
Efeito e características |
|
Pt |
Eletrocatálise |
Custo, atividade, estabilidade |
Controle de liga/núcleo-casca/morfologia |
Aumento da atividade intrínseca, redução da dosagem |
|
Pd |
Síntese química |
Seletividade, recuperação, desativação |
Átomo único/grupo/confinado |
Permite síntese precisa e fácil separação |
|
Au |
Catálise ambiental |
Intrinsecamente inerte, propenso à sinterização |
Controle de dimensão/engenharia de interface |
Ativa o desempenho, aumenta a estabilidade térmica |
4.2 Extração de princípios universais de design
Embora os três catalisadores enfrentem desafios distintos, suas soluções revelam princípios compartilhados no design de materiais catalíticos:
A engenharia interfacial é universalmente crítica: seja nas interfaces Pt-suporte, Au-suporte ou Pd-suporte, essas regiões são fundamentais para a construção de uma catálise sinérgica, aprimorando as interações metal-suporte e melhorando a estabilidade. As interfaces servem como o principal campo de batalha para superar as limitações dos materiais individuais.
A modulação da estrutura eletrônica é fundamental para aprimorar a atividade intrínseca: A modulação dos centros de banda d dos locais ativos por meio de ligas, dopagem, engenharia de tensão e outros meios para otimizar as barreiras de energia de adsorção/dessorção para intermediários de reação representa uma estratégia universal para superar os gargalos da atividade catalítica.
O controle da estrutura geométrica serve como uma ferramenta poderosa para estabilizar catalisadores e regular a seletividade: O controle preciso do arranjo geométrico dos sítios ativos - desde átomos individuais e nanoclusters até planos de cristais de alto índice - pode melhorar simultaneamente a atividade, aumentando o número de átomos de baixa coordenação e, ao mesmo tempo, direcionando com precisão as vias de reação e a seletividade por meio de impedimentos estéricos e efeitos de confinamento.
4.3 Perspectivas futuras
Olhando para o futuro, a pesquisa sobre catalisadores de metais preciosos está avançando para uma nova fase caracterizada por uma profunda integração multidisciplinar, abordagens orientadas por dados e uma forte ênfase no desenvolvimento sustentável.
A integração entre sistemas de materiais e a polinização cruzada de filosofias de projeto surgirão como direções fundamentais. Por exemplo, a aplicação do conceito maduro de estrutura core-shell de catalisadores à base de platina a sistemas de paládio poderia reduzir ainda mais o consumo e os custos do catalisador. Como alternativa, o emprego de estratégias sofisticadas de engenharia interfacial de catalisadores à base de ouro para aumentar a durabilidade de eletrocatalisadores à base de platina poderia gerar novos sistemas catalíticos de alto desempenho por meio dessa fertilização cruzada de ideias.
A evolução sinérgica da inteligência artificial e das técnicas avançadas de caracterização transformará profundamente os paradigmas de P&D: Por um lado, o aprendizado de máquina capacitará a triagem virtual de alto rendimento, identificando rapidamente as soluções ideais a partir de vastas combinações de composição, estrutura e suportes para obter a "personalização sob demanda" de catalisadores. Por outro lado, os avanços nas técnicas de caracterização in-situ/operacional, como a radiação síncrotron e a microscopia eletrônica de varredura ambiental, permitirão a observação em escala atômica em tempo real da evolução estrutural dinâmica em ambientes de reação reais. Essa abordagem unificada revelará a natureza dos locais ativos e dos mecanismos de desativação, orientando um projeto racional mais direcionado.
Em última análise, todos esses avanços tecnológicos devem servir ao grande objetivo do desenvolvimento sustentável. Isso significa que as tecnologias de reciclagem ecológica para metais preciosos e o estabelecimento de sistemas econômicos circulares se tornarão tão importantes quanto o design de desempenho dos próprios catalisadores. Simultaneamente, o desenvolvimento de catalisadores alternativos com cargas ultrabaixas de metais preciosos ou até mesmo alternativas completamente sem metais preciosos será o caminho fundamental para lidar com as restrições de recursos e alcançar o desenvolvimento de longo prazo nos setores químico e energético.

Fig. 10 Aplicações de catalisadores de metais preciosos
Parceiro para soluções catalíticas avançadas
A Stanford Advanced Materials (SAM) fornece catalisadores e suportes de Pt, Pd e Au de alta pureza, adaptados às suas necessidades industriais e de pesquisa e desenvolvimento. Entre em contato com nossa equipe técnica para discutir soluções personalizadas.
Referências
[1] Zandkarimi, B.; Poths, P.; Alexandrova, A. N. When Fluxionality Beats Size Selection: Acceleration of Ostwald Ripening of Sub-Nano Clusters (Aceleração do amadurecimento de Ostwald de aglomerados subnano). Angew. Chem. Int. Ed. 2021, *60* (11), 5701-5704. DOI: 10.1002/anie.202100107.
[2] Zhang, S.; Han, Y.; Zhu, B.; Gao, Y. Particle Hopping and Coalescence of Supported Au Nanoparticles in Harsh Reactive Environments. J. Am. Chem. Soc. 2025. DOI: 10.1021/jacs.5c03633.
[3] Liu, L.; Lu, J.; Wang, L.; Xiao, F.-S. O zeólito Beta desaluminado reverte o amadurecimento de Ostwald para catalisadores duráveis de nanopartículas de cobre. Science 2023, *382* (6673), 771-776. DOI: 10.1126/science.adj1962.
[4] Li, W.; Ouyang, R. Stability of Nanocatalysts under Reaction Conditions (Estabilidade de nanocatalisadores sob condições de reação): A Theoretical Study. J. Am. Chem. Soc. 2013, *135* (5), 1760-1771. DOI: 10.1021/ja3087054.
[5] Li, W., & Ouyang, R. (2013). Stability of Nanocatalysts under Reaction Conditions (Estabilidade de nanocatalisadores sob condições de reação): A Theoretical Study. Journal of the American Chemical Society, 135(5), 1760-1771. DOI: 10.1021/ja3087054.
[6] Yin, P., Hu, S., Liang, H., & Li, W. (2021). Quantificação da distância crítica das partículas para mitigar a sinterização do catalisador. Nature Communications, 12, 4865. DOI: 10.1038/s41467-021-25116-2.

 Barras
Barras
 Miçangas e esferas
Miçangas e esferas
 Parafusos e porcas
Parafusos e porcas
 Cadinhos
Cadinhos
 Discos
Discos
 Fibras e tecidos
Fibras e tecidos
 Filmes
Filmes
 Flocos
Flocos
 Espumas
Espumas
 Folha de alumínio
Folha de alumínio
 Grânulos
Grânulos
 Favos de mel
Favos de mel
 Tinta
Tinta
 Laminado
Laminado
 Nódulos
Nódulos
 Malhas
Malhas
 Filme metalizado
Filme metalizado
 Placa
Placa
 Pós
Pós
 Vara
Vara
 Folhas
Folhas
 Cristais individuais
Cristais individuais
 Alvo de pulverização
Alvo de pulverização
 Tubos
Tubos
 Lavadora
Lavadora
 Fios
Fios
 Conversores e calculadoras
Conversores e calculadoras
 Escreva para nós
Escreva para nós



 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


