Os usos do vanádio e seus usos de acordo com seus estados de oxidação
Este conteúdo foi extraído de uma bolsa de estudos da Stanford Advanced Materials College 2025 enviada por Addison Boyle.
Introdução
O vanádio faz parte dos metais de transição; seu número atômico é 23. Sua abundância na crosta terrestre é de cerca de (0,02%), semelhante à do zinco.1 Apesar de sua abundância, ele não recebeu muita atenção até os últimos 50 anos. Pesquisas mostraram que o vanádio poderia ter uma finalidade biológica por meio do íon vanadato.2 Há pelo menos 6 estados de oxidação diferentes; o vanádio existe principalmente em +3, +4 e +5. Quando isolado, cada um dos estados de oxidação apresenta uma cor diferente. O V4+ é azul, o V3+ é verde e o V2+ é violeta.3 Essas oxidações também são as mais relevantes para os sistemas biológicos.4
Vanádio no sangue:
Esses estados de oxidação do vanádio são importantes porque podem passar por reações redox.4 A estabilidade se baseia na ligação, no solvente e no pH.2 Biogenicamente, isso significa que há agentes redutores que podem converter o vanádio em estados de oxidação mais baixos.4 Esse processo depende do pH; quando o pH aumenta, os potenciais redox diminuem.4 Quando tomado na forma de medicamento, ele entra na corrente sanguínea e nos constituintes do soro sanguíneo.4 A reação com o vanádio determina a especiação do vanádio.1
Em condições levemente ácidas, o V(III), quando formado, assemelha-se aos sistemas biológicos existentes.1 O plasma sanguíneo pode ter os agentes redutores presentes que podem levar à estabilização do V(III), permitindo a formação de espécies de V(III)2-hTF.1 Essasespécies assemelham-se ao Fe(III) 2-hTF, que é reconhecido pelos receptores celulares.1 Isso pode ser feito quando o V(III) ou o Fe(III) são atraídos pela hTF se o V(IV)O no plasma sanguíneo estiver disponível, então uma redução para V(III) poderia ser favorável devido ao ganho de energia.1 A ligação do V(III) tem um logK 20, enquanto que se o V(IV)O+2 tem um logK 13.1 Essa reação precisa ocorrer em condições levemente ácidas.1
Observou-se que outros estados de oxidação do vanádio (V(IV) e V(V)) podem sofrer troca de ligantes e interconversão redox.1 Os ligantes de baixa massa molecular são o lactato e o citrato, e os de alta massa molecular são a hTF, a albumina e a imunoglobulina G.1 Como no V(III), o V(IV) e o V(V) reagem bem devido aos resíduos dos locais de ligação do Fe(III) do hTF.1 Como o Fe(III) 2-hFT é reconhecido pelos receptores celulares para endocitose.1 Quando o V(IV)OSO4 e o apo-hTF são incubados, é demonstrado que correspondem ao hTF.1 Também é demonstrado que a proporção de formação é menor do que a do Fe(III) 2hTF.1Foi observado que os complexos VIVO e VIVO-portador, juntamente com o V(V) como monovanadato, podem se ligar à holo-hTF, que é o agente de transporte no sangue.1 Isso significa que o vanádio pode estar presente no plasma sanguíneo e passar por endocitose quando a holo-entrada nas células.1
Vanadato:
Há três tipos principais de reações que podem ser realizadas com o vanadato na química aquosa: reações de autocondensação, reações de coordenação e reações redox.4
Para as reações de condensação, os ânions de vanadato são protonados por oligômeros em um ambiente levemente ácido para torná-lo mais favorável.4 Isso é fundamental para a função celular devido à forma como o pH afeta as diferentes organelas.4 Nas células tumorais, foi demonstrado que elas têm um pH elevado das organelas.4 Isso poderia significar que o vanadato poderia ser usado para encontrar as células tumorais com o pH elevado.4 Isso poderia ser feito com uma série de oligômeros de vanadato em um ambiente ácido.4
Como o vanadato tem semelhanças com o fosfato, o vanadato começou a ser usado em reações de coordenação, mas ainda está principalmente no estágio de tubo de ensaio, o que significa que a maioria das reações coordenadas é teórica.4 O fosfato é importante para os sistemas biológicos e está envolvido em muitos sistemas biológicos de reconhecimento e biocatalíticos.1 Onde VO43- tem semelhança estrutural e eletrônica com PO43- Fig 1.4 Os complexos de vanadato têm geometrias trigonais-bipiramidais de 5 coordenadas, correspondendo aos estados de transição de 5 coordenadas que se supõe serem formados na reação de enzimas dependentes de fosfato Fig 1.1 Embora possa haver ligantes mono e polidentados, os mais usados são os ésteres de vanadato e os anidridos de vanadato, por serem análogos ao fosfato. 4 Com a modelagem por computador, a maior parte do vanadato estava na forma de H2VO4- e HVO42- quando se excluíam as proteínas; quando as proteínas eram incluídas, a maior parte do vanádio estava ligada à transferrina.4 Quando o complexo metálico de vanadato é estabilizado por ligantes, isso aumenta a chance de redução.4 Isso leva a reações de coordenação que tendem a reduzir em sistemas biológicos.4
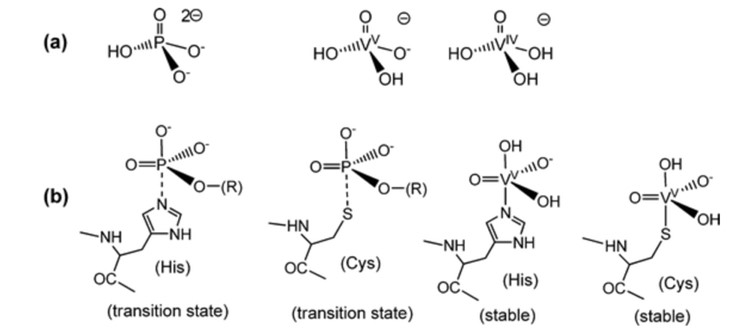
Fig. 1. Comparação de fosfatos e vanadatos com estados de transição e estabilidade.5
Nas reações redox em sistemas biológicos, os estados de oxidação que importam do vanádio são +3, +4 e +5.4 A maior parte da redução do vanadato é para V(IV) a partir de V(V).4 Esse tipo de reação ocorre em várias biomoléculas, especialmente em organelas.4 Ele também é usado como um tampão para proteínas fosfotirosiladas.4 Isso leva à intervenção na via de sinalização da insulina.4 Isso pode ser usado no tratamento do diabetes porque, uma vez ligado ao local ativo da enzima, o vanadato não é facilmente liberado como o fosfato.1 Isso bloqueia o local do fosfato, levando a uma inibição da enzima.1 Há desvantagens no uso do vanadato para tratar o diabetes, como o estresse oxidativo induzido pelo vanádio, problemas de toxicidade global, efeitos no sistema imunológico e inflamação.1
Pesquisa sobre o câncer:
As propriedades do vanádio têm sido investigadas quanto aos seus efeitos quimiopreventivos e antitumorais na luta contra o câncer.1 Os testes parecem estar principalmente nos estágios de testes em animais e em linhagens de células malignas.1 O dicloreto de vanadoceno e vários peroxovanadatos são os principais compostos de vanádio usados.1 O dicloreto de vanadoceno é solúvel em água e, em um pH de 7, os íons de cloreto são substituídos por H2O, resultando em V(C5H5)2]2+.1 Foi observado que ele se liga ao DNA, causando um comportamento diferente da cisplatina.1 Também demonstrou toxicidade limitada, nenhuma transferência através da barreira sanguínea e não é detectado no cérebro.1 Os alvos das propriedades anticancerígenas do vanádio são a interrupção do metabolismo celular, as vias de transdução de sinal e a interrupção da proliferação celular.1 Houve preocupações sobre as diversas respostas e a segurança do vanádio, o que levou à falta de pesquisas clínicas.1 Com essas preocupações em mente, as pessoas ainda estão fazendo pesquisas.1 Os sistemas de V(V)-mhcpe foram testados in vitro e obtiveram resultados de que são mais tóxicos para as células tumorais do que para as células não tumorais.1 Os complexos de V(IV) que têm derivados de 1-10-fenantrolina como ligantes e os complexos de V(IV)O-dppz mostraram propriedades anticancerígenas Fig. 2, especialmente contra a leucemia.1
Fig. 2. Representação do antitumor dos compostos de vanadato, com estabilidade do tampão pH 7,1
Amavadina:
Existe um fungo que acumula vanádio chamado Amanita muscaria, ou agárico-mosca.6 Um cogumelo comum contém menos de 0,5 mg de V kg-1, mas o A. muscaria pode conter 100 mg de V kg-1.6 As partes do corpo do cogumelo que contêm vanádio são o estipe, a pele do chapéu, a polpa do chapéu, as brânquias, os esporos e o bulbo.6 A maior concentração de vanádio está no bulbo, com 1000 mg V kg-1.6 Essa parte do cogumelo está localizada na parte mais baixa do estipe, o que a torna mais suscetível à contaminação do solo.6 Ao analisar o solo superficial, a mediana de vanádio foi de 60 mg kg-1, com uma variação de 1,28 a 537 mg kg-1.6 O vanádio encontrado no A. muscaria tinha carga negativa e foi denominado amavadina Fig. 3 por Bayer e Kneifel.6 Descobriu-se, por meio de espectroscopia de ressonância paramagnética eletrônica (EPR), que o estado de oxidação do vanádio era +4.6 Os espectros de EPR também indicaram que as diferentes partes do cogumelo continham o mesmo composto amavadina.6 São dois ligantes tetradentados mostrados na Fig. 3 que podem se coordenar com o centro de vanádio, criando dois isômeros que aparecem em misturas quase iguais na amavadina sintética e natural.6
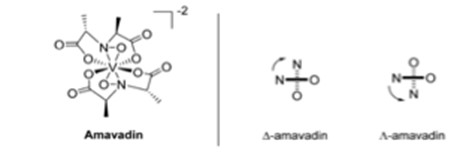
Fig. 3. Estrutura do amavadin, com os isômeros D e L.6
A oxidação de V(IV) em V(V) é reversível na amavadina, o que significa que ela pode ter propriedades catalíticas.6 Descobriu-se que uma ampla gama de reações era catalisada pelo complexo.6 Isso levou à síntese de diferentes análogos da amavadina com diferentes centros de íons metálicos ou ligantes modificados.6 Quando a amavadina foi sintetizada a partir da A. muscaria, verificou-se que havia diferentes complexos de vanádio, sendo o mais proeminente o acetato de vanadila.6 O sólido foi encontrado com 26% (p/p) de acetato de vanadila e 74% (p/p) de amavadina.6
Conclusão
Em conclusão, foi demonstrado que o vanádio tem vários usos em sistemas biológicos. Desde o tratamento do câncer até os cogumelos. As pesquisas têm investigado os diferentes estados de oxidação e como eles podem ser reduzidos em sistemas biológicos, como no sangue ou nas células. Os principais estados de oxidação do vanádio são +3, +4 e +5. Os ligantes normalmente associados ao vanádio eram complexos de oxigênio, especialmente vanadato e acetato de vanadila. Ainda há mais pesquisas a serem feitas sobre o vanádio e os efeitos que ele terá na comunidade científica.
Referências:
1. J.Costa Pessoa, Journal of Inorganic Biochemistry, 2015, 147, 4-24
2. A. Butler e C. J. Carrano, Coordination Chemistry Reviews, 1991, 109, 61-65
3. D. Rehder, Bioinorganic Vanadium Chemistry, Wiley, Incorporated, New York, 2008.
4. X. Yang e K. Wang, em Progress in Molecular and Subcellular Biology, eds. W. E. G. Muller, P. Jeanteur, R. E. Rhoads, D. Ugarkovic e M. R. Custodio. Springer, Manz, Alemanha, 2013, cap. 1, pp. 1-19.
5. D. Rehder, Metallomics, 2015, 7, 732
6. S. Braeuer, M. Walenta, L. Steiner e W. Goessler, Royal Society of Chemistry, 2021, 36, 954-967.

 Barras
Barras
 Miçangas e esferas
Miçangas e esferas
 Parafusos e porcas
Parafusos e porcas
 Cadinhos
Cadinhos
 Discos
Discos
 Fibras e tecidos
Fibras e tecidos
 Filmes
Filmes
 Flocos
Flocos
 Espumas
Espumas
 Folha de alumínio
Folha de alumínio
 Grânulos
Grânulos
 Favos de mel
Favos de mel
 Tinta
Tinta
 Laminado
Laminado
 Nódulos
Nódulos
 Malhas
Malhas
 Filme metalizado
Filme metalizado
 Placa
Placa
 Pós
Pós
 Vara
Vara
 Folhas
Folhas
 Cristais individuais
Cristais individuais
 Alvo de pulverização
Alvo de pulverização
 Tubos
Tubos
 Lavadora
Lavadora
 Fios
Fios
 Conversores e calculadoras
Conversores e calculadoras
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


