Entendendo o envenenamento do catalisador em catalisadores de metais preciosos: Causas, problemas e soluções
1 Introdução
Os catalisadores de metais preciosos desempenham uma função importante na indústria química, no setor de energia e na proteção ambiental. Devido à sua estrutura eletrônica e propriedades de superfície exclusivas, os catalisadores de metais preciosos podem catalisar com eficiência várias reações químicas. No entanto, na prática, os tóxicos costumam afetar esses catalisadores, resultando em diminuição da atividade, alteração da seletividade e até mesmo redução da vida útil. Para enfrentar esse desafio, este blog discutirá em detalhes os mecanismos e as aplicações de catalisadores de metais preciosos, examinará as causas e os efeitos do envenenamento de catalisadores e proporá medidas para aprimorar seus recursos antivenenos e sua vida útil.

Fig. 1 Pó preto de platina (grau de célula de combustível) fornecido pela Stanford Advanced Materials
2 Introdução aos catalisadores de metais preciosos
2.1 Mecanismos dos catalisadores de metais preciosos
Em termos de estrutura eletrônica, os metais nobres (por exemplo, platina, paládio, ródio, irídio, etc.) têm orbitais de elétrons d preenchidos ou quase preenchidos. Esses orbitais de elétrons d podem se sobrepor efetivamente aos orbitais das moléculas reagentes, fornecendo assim a energia de ativação necessária para que a reação possa ser realizada com uma barreira de energia menor. A participação dos elétrons d permite que os metais preciosos formem intermediários com uma ampla variedade de reagentes (por exemplo, hidrogênio, oxigênio, hidrocarbonetos etc.) e facilitem o processo de reação. A alta densidade de elétrons e a uniformidade de distribuição dos átomos de metais preciosos proporcionam uma alta densidade de nuvem de elétrons em suas superfícies. Isso ajuda o catalisador de metal nobre a fornecer ou aceitar elétrons na reação, desempenhando o papel de um bom doador ou aceitador de elétrons e promovendo a reação.
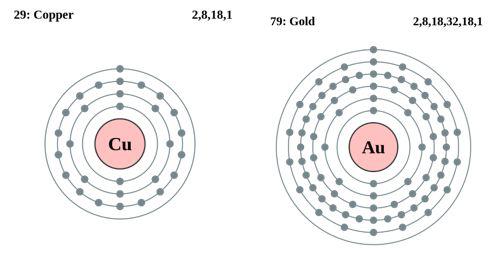
Fig. 2 Arranjos periféricos de elétrons dos átomos de cobre e ouro
Do ponto de vista das propriedades da superfície, a superfície do metal precioso tem uma forte capacidade de adsorção, que pode efetivamente adsorver moléculas reagentes. Essa capacidade de adsorção vem principalmente da forte interação entre os átomos de metais preciosos e a alta atividade dos átomos da superfície. Os catalisadores de metais preciosos podem interagir com moléculas reagentes por meio de adsorção física e química, fornecendo locais ativos para promover a reação. As superfícies dos catalisadores de metais preciosos também têm boa capacidade de reconstrução. Durante o processo de reação, a superfície dos átomos de metais preciosos pode sofrer um certo grau de reconstrução para se adaptar à adsorção e à reação de diferentes moléculas reagentes. Essa capacidade de remodelação da superfície ajuda o catalisador a manter uma atividade catalítica eficiente sob diferentes condições de reação.
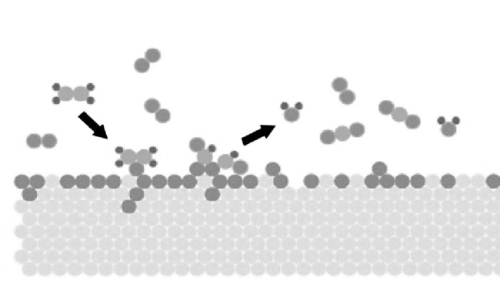
Fig. 3 Diagrama esquemático da reação de moléculas de gás adsorvidas na superfície de metais preciosos
Além disso, os metais preciosos têm alta estabilidade termodinâmica e podem manter sua estrutura e atividade catalítica em altas temperaturas e em ambientes químicos adversos. Isso permite que os catalisadores de metais preciosos apresentem excelente durabilidade e estabilidade em uma ampla gama de reações industriais (por exemplo, craqueamento em alta temperatura, reações de oxidação etc.).
Os catalisadores de metais preciosos são capazes de catalisar muitos tipos de reações, incluindo hidrogenação, oxidação, desproporção, acoplamento e assim por diante. Essa versatilidade se deve principalmente aos seus abundantes locais de superfície ativa e estruturas eletrônicas flexíveis, que permitem que os metais preciosos se adaptem a diferentes mecanismos e condições de reação. Diferentes tipos de metais preciosos também podem formar ligas com outros metais para regular ainda mais suas estruturas eletrônicas e propriedades de superfície. Por exemplo, os catalisadores de liga de platina e paládio apresentam desempenho catalítico superior ao de metais individuais em determinadas reações. A liga pode otimizar a atividade, a seletividade e a estabilidade dos catalisadores de metais preciosos, melhorando assim seu desempenho geral.
2.2 Aplicações dos catalisadores de metais preciosos
Os catalisadores de metais preciosos são usados no tratamento de gás para proteger o meio ambiente devido ao seu efeito catalítico nas reações de gás. Os catalisadores ternários comumente usados no tratamento de escapamento de automóveis usam platina (Pt), paládio (Pd) e ródio (Rh) como os principais componentes para converter monóxido de carbono (CO), óxidos de nitrogênio (NOx) e hidrocarbonetos não queimados (HC) no escapamento do automóvel em dióxido de carbono (CO2), nitrogênio (N2) e água (H2O) inofensivos. A platina e o paládio também são usados em sistemas de tratamento de exaustão de diesel para oxidar partículas de carbono e óxidos de nitrogênio emitidos por motores a diesel. O tratamento de gás de escapamento em usinas químicas industriais e refinarias também usa catalisadores de metais preciosos, como platina e paládio, para tratamento, o que pode remover com eficácia os componentes nocivos do gás de escapamento. Os sensores químicos baseados em catalisadores de metais preciosos são usados para detectar poluentes gasosos, gases tóxicos e biomoléculas no ambiente, por exemplo, sensores de hidrogênio e sensores de formaldeído. Os catalisadores de metais preciosos também são usados para a degradação de poluentes, como a degradação fotocatalítica de poluentes orgânicos no tratamento de água, e catalisadores compostos de óxidos de platina e titânio na hidrólise fotocatalítica da água para a produção de hidrogênio.
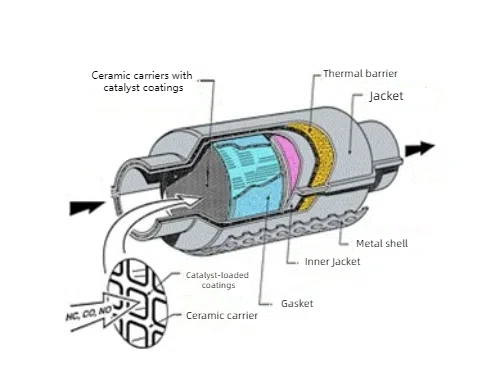
Fig. 4 Estrutura do conversor catalítico de três vias
No campo da energia, os catalisadores de metais preciosos, especialmente os catalisadores de platina, são usados no processo eletroquímico de eletrólise da água e na oxidação da célula de combustível de metanol para aumentar a eficiência da conversão de energia elétrica. Os catalisadores de platina nas células de combustível de membrana de troca de prótons (PEMFC) promovem a reação eletroquímica entre o hidrogênio e o oxigênio nos eletrodos para gerar eletricidade e água. Os catalisadores de liga de platina e rutênio em células de combustível de metanol direto (DMFC) são usados para oxidar o metanol e melhorar a eficiência da célula de combustível. Os eletrodos de platina também podem ser usados para eletrolisar a água para produzir hidrogênio, melhorando a eficiência da reação. Os catalisadores de metais preciosos também são usados na conversão de biomassa para transformar matérias-primas de biomassa em produtos químicos e combustíveis de alto valor agregado, como a reação de hidrodesoxigenação na produção de biodiesel.
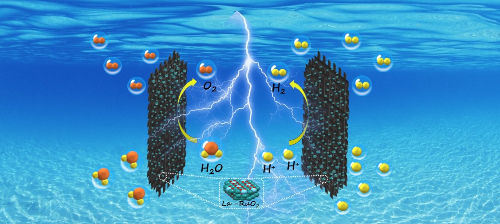
Fig. 5 Produção de hidrogênio a partir de água eletrolítica ácida catalisada por La-RuO2 [5]
Na produção química, os catalisadores de metais preciosos são amplamente utilizados em aplicações relacionadas a orgânicos. No setor de refino de petróleo, os catalisadores de platina e paládio podem ser usados no processo de hidrodessulfurização para remover sulfetos do petróleo bruto, o que pode melhorar a qualidade do combustível. No processo de reforma do petróleo, os catalisadores de platina também ajudam na produção de gasolina de alta octanagem e compostos aromáticos. No setor de síntese orgânica, os catalisadores de platina e paládio são amplamente usados para catalisar reações de hidrogenação, melhorando significativamente a eficiência do processo de hidrogenação de ligações duplas e triplas de vários compostos orgânicos. Os catalisadores de paládio também podem catalisar a reação de acoplamento Suzuki e a reação de Heck, que desempenham um papel importante na síntese de medicamentos e na construção de moléculas orgânicas complexas. No campo da síntese de medicamentos, os catalisadores de metais preciosos são frequentemente usados para transformações químicas em etapas importantes, como as reações de acoplamento cruzado catalisadas por paládio, que desempenham uma função insubstituível na síntese de moléculas complexas de medicamentos. Os catalisadores de platina e paládio também são comumente usados na catálise quiral, catalisando processos de reação de hidrogenação assimétrica para produzir intermediários quirais de medicamentos, garantindo a pureza óptica e a atividade biológica dos medicamentos. Os catalisadores de metais preciosos têm aplicações importantes na preparação de nanomateriais, como o uso de catalisadores de platina e ouro para preparar nanomateriais de alto desempenho para uso em dispositivos eletrônicos e optoeletrônicos.
3 Envenenamento por catalisador
3.1 Definição de envenenamento por catalisador
O envenenamento do catalisador refere-se à perda ou à redução significativa da atividade catalítica de um catalisador durante uma reação química devido à presença de determinadas substâncias (conhecidas como venenos ou substâncias venenosas). Esses venenos quimissorvem ou reagem fortemente com os locais ativos do catalisador, impedindo que o catalisador entre em contato e reaja normalmente com os reagentes. O envenenamento do catalisador é um fenômeno desfavorável que leva a uma redução na eficiência da reação química ou até mesmo à sua interrupção completa.
3.2 Causas e tipos de envenenamento do catalisador
Há três mecanismos principais de envenenamento do catalisador.
1. Adsorção química: Forte adsorção química de moléculas de veneno com os locais ativos do catalisador, de modo que esses locais não possam continuar a reagir com os reagentes.
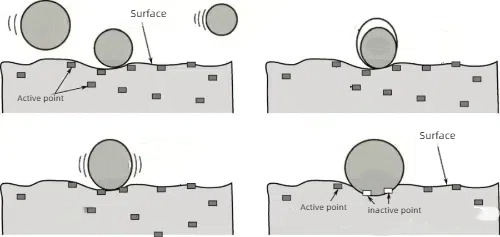
Fig. 6 Princípio esquemático da quimissorção
2. Reação química: O tóxico reage com os componentes ativos do catalisador para produzir compostos inativos que cobrem a superfície do catalisador.
3. Bloqueio físico: Certos venenos formam depósitos na superfície do catalisador, bloqueando fisicamente os poros ou locais ativos do catalisador.
A desativação causada pelo envenenamento do catalisador é diferente devido a diferentes causas e graus.
1. Envenenamento temporário (envenenamento reversível): Quando o veneno é adsorvido ou combinado quimicamente no centro ativo, a força de ligação gerada é relativamente fraca, e métodos apropriados podem ser adotados para remover o veneno, de modo que a atividade do catalisador possa ser restaurada sem afetar a natureza do catalisador, e esse tipo de envenenamento é chamado de envenenamento reversível ou envenenamento temporário.
2. Envenenamento permanente (envenenamento irreversível): O veneno interage com os componentes ativos do catalisador para formar uma ligação química muito forte, e é difícil remover o veneno de forma geral para restaurar a atividade do catalisador.
3. Envenenamento seletivo: Após o envenenamento, o catalisador pode perder a capacidade catalítica para uma determinada reação, mas ainda ter atividade catalítica para outras reações. Em uma série de reações, se o veneno causar apenas o envenenamento do sítio ativo da reação subsequente, a reação pode permanecer no estágio intermediário e obter um alto rendimento de produtos intermediários.
4 Problemas causados pelo envenenamento do catalisador
4.1 Redução da atividade do catalisador
1. Ocupação dos locais ativos: As toxinas quimissorvem ou reagem fortemente com os locais ativos na superfície do catalisador, fazendo com que esses locais sejam ocupados pela toxina e impedindo a adsorção e a reação das moléculas reagentes, resultando em uma redução significativa da atividade do catalisador. Por exemplo, sulfetos (p. ex., H2S) reagem com a superfície de catalisadores de platina ou paládio para formar sulfeto de platina ou sulfeto de paládio, tornando esses locais ativos inúteis.
2. Cobertura da superfície: As toxinas formam uma camada de cobertura na superfície do catalisador que impede fisicamente que os reagentes alcancem os locais ativos do catalisador. Esse efeito de cobertura também reduz muito a área de superfície efetiva do catalisador e diminui sua atividade. Por exemplo, os fosfatos formam uma camada de cobertura na superfície de alguns catalisadores que impede a adsorção de reagentes.
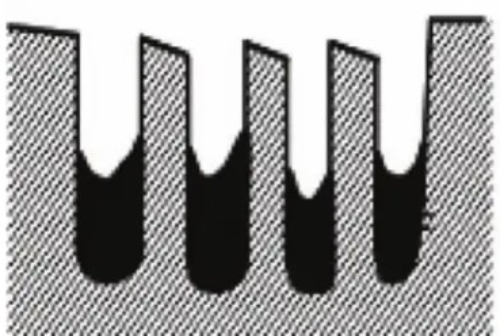
Fig. 7 Estrutura do catalisador passivada após a cobertura da superfície
4.2 Alterações seletivas
1. Ocupação específica de locais ativos
Certos tóxicos se ligam seletivamente a locais ativos específicos, resultando na modificação da atividade e da função desses locais. Por exemplo, determinadas reações podem depender de tipos específicos de sítios ativos (por exemplo, sítios localizados em determinados planos de cristal ou em arranjos atômicos específicos), e a adsorção de tóxicos ocupará preferencialmente esses sítios, alterando assim a seletividade geral do catalisador.
Por exemplo, na hidrogenação seletiva do etileno, os catalisadores de Pd apresentam alta seletividade, mas se a superfície do catalisador for envenenada por enxofre (S), os átomos de enxofre serão preferencialmente adsorvidos nos locais ativos da superfície do Pd, alterando as propriedades da superfície do catalisador e resultando em uma reação mais inclinada a produzir etano indesejado em vez de etileno.
2. Alteração do caminho da reação
A presença de um tóxico pode alterar o caminho de uma reação catalisada, mesmo que não ocupe totalmente o local ativo, alterando as propriedades eletrônicas ou geométricas da superfície do catalisador, dificultando a formação de determinados intermediários ou estados de transição ou aumentando a probabilidade de decomposição, resultando na orientação da reação para um produto diferente.
Um exemplo típico é a alteração na densidade de elétrons na superfície de um catalisador de ródio (Rh) após o envenenamento do catalisador por fósforo (P) na reação de hidroformilação do propileno, resultando em uma mudança do principal produto gerado de n-butiraldeído para isobutiraldeído, uma alteração na seletividade que se deve ao efeito estabilizador diferente do fósforo nos intermediários da reação.
3. Remodelamento da superfície e alterações geométricas
A adsorção de tóxicos na superfície do catalisador pode causar rearranjo ou remodelagem de átomos ou moléculas na superfície do catalisador, alterando a geometria da superfície do catalisador e, portanto, afetando a adsorção e os caminhos de reação das moléculas reagentes. Essas alterações geométricas podem levar a uma diminuição ou perda completa da seletividade para determinadas reações específicas.
Na reação de síntese de Fischer-Tropsch, os catalisadores de ferro (Fe) são usados para a síntese de hidrocarbonetos de cadeia longa. Ainda assim, quando a superfície do catalisador de Fe é envenenada por enxofre, os átomos de enxofre causam uma remodelação da superfície que diminui a geração de hidrocarbonetos de cadeia longa e aumenta a geração de metano e hidrocarbonetos de cadeia curta. Essa mudança de seletividade se deve à alteração na estrutura geométrica dos locais ativos na superfície.
Fig. 8 Princípio esquemático do processo Fischer-Tropsch
4. Mudanças na estabilidade dos intermediários
A presença de substâncias tóxicas pode alterar a estabilidade dos intermediários da reação na superfície do catalisador, resultando em uma dessorção mais fácil ou em uma geração mais difícil de determinados intermediários, limitando, assim, a distribuição do produto final da resposta.
Na reação de oxidação do propileno, o catalisador de molibdênio (Mo) é usado para gerar acroleína, mas se o catalisador for envenenado por cloro (Cl), o cloro altera a estabilidade dos intermediários da reação (por exemplo, óxido de propileno), o que resulta em uma diminuição na seletividade da geração de acroleína e um aumento na geração de produtos de oxidação incompleta, como o dióxido de carbono.
5. Efeito eletrônico
A adsorção de tóxicos altera o ambiente eletrônico na superfície do catalisador, afetando a energia de adsorção e as barreiras de energia de reação dos reagentes. Especialmente quando o tóxico é fortemente eletronegativo ou pode formar uma diferença de densidade de elétrons com a superfície do metal, esse efeito eletrônico pode alterar significativamente a seletividade da reação do catalisador.
Na reação de oxidação parcial do metanol, os catalisadores de ouro (Au) são usados para gerar formaldeído, mas quando o oxigênio (O2) ou os óxidos (por exemplo, alumina) estão presentes, os átomos de oxigênio adsorvidos alteram a densidade eletrônica na superfície dos catalisadores de ouro, levando à oxidação adicional do formaldeído em ácido fórmico ou até mesmo em dióxido de carbono, o que reduz a seletividade do formaldeído.
4.3 Redução da vida útil do catalisador
Os fenômenos de envenenamento geralmente são irreversíveis, especialmente quando o tóxico reage fortemente com o catalisador para produzir um composto estável. Essa desativação irreversível significa que o catalisador não pode ser restaurado à sua atividade após um longo período por meio de tratamentos simples (por exemplo, regeneração), reduzindo significativamente a vida útil do catalisador.
Além disso, a ação dos venenos pode levar a alterações na estrutura da superfície do catalisador ou até mesmo causar aglomeração ou sinterização das partículas do catalisador, o que reduz ainda mais a estabilidade e a vida útil do catalisador.
4.4 Aumento dos custos do processo
Como o fenômeno da toxicação leva a uma redução na atividade e na vida útil do catalisador, o processo exige uma substituição ou regeneração mais frequente do catalisador, o que aumenta os custos de produção. Além disso, pré-tratamentos complexos da matéria-prima, como a dessulfurização e a desfosforização, podem ser necessários antes da reação para reduzir os efeitos da toxicidade, aumentando ainda mais os custos operacionais e o investimento em equipamentos.
5 Medidas para lidar com a intoxicação do catalisador
5.1 Modificação do catalisador
1. Liga: A liga é a formação de catalisadores com propriedades aprimoradas por meio da combinação de metais preciosos com outros metais. Esse método é eficaz para melhorar a resistência do catalisador à toxicidade. Por exemplo, o paládio (Pd) é ligado a outros metais, como ouro (Au) ou prata (Ag), para melhorar sua resistência a compostos de enxofre e nitrogênio.
Os sulfetos são um dos venenos comuns de catalisadores, especialmente em processos químicos e de refino de petróleo. Com a liga de paládio (Pd) com ouro (Au) ou prata (Ag), a resistência de um catalisador a sulfetos pode ser significativamente aprimorada. Por exemplo, os catalisadores com liga de paládio e ouro oferecem maior resistência ao envenenamento por sulfeto em comparação com os catalisadores de paládio puro porque a presença de ouro altera a estrutura eletrônica da superfície do catalisador e reduz a adsorção de enxofre, diminuindo assim a taxa de envenenamento.
Os nitretos também são uma das principais fontes de envenenamento de catalisadores, especialmente na síntese de amônia e nas reações de desnitrificação. Com a liga de paládio em combinação com outros metais, como cobre Cu ou platina Pt, a tolerância do catalisador aos nitretos pode ser melhorada. A liga pode ajustar a densidade de elétrons e a geometria da superfície do catalisador, reduzir a força de adsorção dos nitretos e retardar a desativação do catalisador.
2. Modificação da superfície: Modificação da superfície do catalisador, como a adição de uma camada de óxido ou carbono à superfície do catalisador de metal nobre, para evitar que os venenos entrem em contato direto com os locais ativos. Por exemplo, revestimento de óxido e modificação da camada de carbono.
A adição de um revestimento de óxido, como óxido de alumínio (Al2O3) ou dióxido de silício (SiO2), à superfície de um catalisador de metal nobre pode melhorar a resistência do catalisador à toxicidade. Por exemplo, um revestimento de alumina na superfície de um catalisador de paládio pode bloquear efetivamente o contato dos sulfetos com os locais ativos na superfície do paládio, melhorando assim a resistência do catalisador de paládio aos sulfetos. Além disso, o revestimento de óxido pode fornecer sítios ácidos ou básicos adicionais, melhorando ainda mais a seletividade e a atividade do catalisador.
A adição de uma camada de carbono à superfície de um catalisador de metal precioso também é um método eficaz de modificação da superfície. A camada de carbono pode evitar o contato direto de tóxicos com os locais ativos do catalisador por meio de adsorção e blindagem. Por exemplo, ao depositar uma camada de grafeno ou de carbono ativado na superfície de um catalisador de paládio, sua tolerância a sulfetos e nitretos pode ser melhorada, mantendo-se uma boa atividade catalítica. A modificação da camada de carbono não apenas melhora a resistência do catalisador à toxicidade, mas também aumenta sua estabilidade térmica e resistência mecânica.
5.2 Pré-tratamento de matérias-primas
O pré-tratamento da matéria-prima é uma etapa fundamental para evitar o envenenamento do catalisador de metais preciosos. Por meio de um tratamento eficaz de dessulfurização, desfosforização e desnitrogenação, o efeito do veneno no catalisador pode ser significativamente reduzido, a vida útil do catalisador pode ser prolongada e seu desempenho catalítico eficiente pode ser mantido.
1. Dessulfurização: A dessulfurização refere-se à remoção de sulfetos da matéria-prima antes da reação para evitar o envenenamento do catalisador por sulfetos. Os sulfetos são um dos venenos comuns do catalisador, especialmente no refino de petróleo e na produção química, onde reagem com os locais ativos na superfície do catalisador, levando à desativação do catalisador. A hidrodessulfurização é uma tecnologia comum de dessulfurização que remove o sulfeto de hidrogênio da matéria-prima reagindo com o sulfeto em alta temperatura e alta pressão usando gás hidrogenado contendo hidrogênio para converter o sulfeto em sulfeto de hidrogênio (H₂S). Esse método remove com eficácia os compostos organossulfurados, como mercaptanos, tioéteres e tioésteres da matéria-prima, reduzindo assim o efeito tóxico desses sulfetos no catalisador.
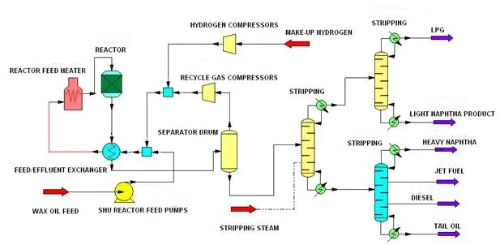
Fig. 9 Processo de hidrodessulfurização
2. Desfosforização: o fosfeto também é uma das principais fontes de envenenamento do catalisador, especialmente em determinadas reações catalíticas, o fosfeto reagirá com a superfície do catalisador, levando à falha do local ativo. Portanto, é muito necessário usar o agente desfosforizante para desfosforizar a matéria-prima. Um agente desfosforizante é um reagente químico projetado especificamente para remover o fosfeto da matéria-prima. O agente desfosforizante reage com os fosfetos na matéria-prima para formar um precipitado sólido que é insolúvel na matéria-prima e, portanto, os remove. Por exemplo, em alguns processos industriais, agentes desfosforizantes à base de cálcio podem ser usados para reagir com fosfatos e formar precipitados de fosfato de cálcio, atingindo assim o objetivo da desfosforização.
3. Desnitrogenação: Os compostos que contêm nitrogênio também são uma das causas importantes de envenenamento do catalisador, especialmente em reações de síntese petroquímica e orgânica, em que os compostos de nitrogênio se combinam com os locais ativos do catalisador, levando à desativação do catalisador. Para evitar isso, é necessária a desnitrificação da matéria-prima. Os compostos que contêm nitrogênio também são uma das causas importantes de envenenamento do catalisador, especialmente em reações de síntese petroquímica e orgânica, em que os nitretos se combinam com os locais ativos do catalisador, levando à desativação do catalisador. Para evitar essa situação, é necessária a desnitrificação das matérias-primas.
5.3 Otimização das condições de reação
1. Controle da temperatura da reação: a temperatura da reação tem influência direta sobre a atividade e a estabilidade do catalisador. O comportamento de adsorção e dessorção de reagentes e intermediários, bem como a taxa de geração de venenos, mudará sob diferentes condições de temperatura. Ao otimizar a temperatura da reação, a geração e a adsorção de substâncias tóxicas podem ser reduzidas. A realização da reação em temperaturas mais baixas reduz a geração de determinados subprodutos tóxicos. Muitos tóxicos (por exemplo, sulfetos, fosfetos) são mais facilmente formados em temperaturas mais altas, e a redução da temperatura da reação pode inibir a formação desses subprodutos. Por exemplo, no processo de hidrogenodessulfurização (HDS), a produção de sulfeto de hidrogênio (H₂S) pode ser reduzida com a diminuição da temperatura da reação, protegendo o catalisador do envenenamento por sulfeto. As baixas temperaturas ajudam a reduzir a adsorção de venenos na superfície do catalisador. As altas temperaturas aumentam a energia cinética dos reagentes e venenos, facilitando a forte quimissorção deles com os locais ativos na superfície do catalisador, o que pode levar ao envenenamento do catalisador. Ao controlar a temperatura da reação, a adsorção de venenos pode ser reduzida e o ciclo ativo do catalisador pode ser prolongado.
2. Controle da pressão do hidrogênio: na reação de hidrogenação, a pressão do hidrogênio é um parâmetro fundamental, que afeta diretamente a taxa de reação e a seletividade do catalisador. Ao otimizar a pressão do hidrogênio, a hidrogenação excessiva e a formação de venenos podem ser efetivamente reduzidas, protegendo assim o catalisador de metais preciosos contra envenenamento. Nas reações de hidrogenação, uma pressão de hidrogênio muito alta pode levar à hidrogenação excessiva dos reagentes e à geração de produtos totalmente hidrogenados indesejados. Por exemplo, em uma reação de hidrogenação parcial de alcinos, uma pressão de hidrogênio muito alta pode levar à hidrogenação excessiva dos alcinos em alcanos, em vez das olefinas do produto-alvo. Ao controlar a pressão do hidrogênio, o grau de hidrogenação dos reagentes pode ser regulado com precisão para evitar a hidrogenação excessiva, melhorando assim a seletividade da reação e protegendo a atividade do catalisador. A pressão do hidrogênio também afeta a geração de venenos. Em algumas reações, a pressão excessiva de hidrogênio pode promover a ocorrência de reações secundárias e a geração de subprodutos tóxicos. Por exemplo, na oxidação parcial do metano, a pressão excessiva de hidrogênio pode levar a uma maior oxidação do formaldeído em ácido fórmico ou dióxido de carbono, aumentando assim a toxicidade dos venenos para o catalisador. Ao otimizar a pressão do hidrogênio, a ocorrência dessas reações colaterais pode ser inibida, a formação de venenos pode ser reduzida e a atividade do catalisador pode ser protegida.
5.4 Regeneração do catalisador
A regeneração do catalisador é uma parte importante do processo para evitar o envenenamento de catalisadores de metais preciosos. Os catalisadores serão inevitavelmente contaminados por venenos no decorrer do uso, o que levará a uma diminuição da atividade catalítica. Por meio de técnicas de regeneração adequadas, os venenos na superfície do catalisador podem ser removidos e seu desempenho catalítico pode ser restaurado.

Fig. 10 Comparação da aparência de vários catalisadores antes e depois da regeneração
1. Regeneração química: Remoção de venenos da superfície do catalisador por métodos químicos, como tratamento de oxidação ou redução. Esse método geralmente inclui tratamento de oxidação e tratamento de redução.
O tratamento de oxidação remove os tóxicos da superfície do catalisador por meio da introdução de oxigênio ou outros agentes oxidantes para oxidar e decompor os tóxicos orgânicos ou outras substâncias oxidáveis na superfície do catalisador. Por exemplo, para um catalisador contaminado com hidrocarbonetos, o ar ou o oxigênio pode ser introduzido em alta temperatura para oxidar os hidrocarbonetos na superfície em dióxido de carbono e água, removendo assim os venenos.
Os tratamentos de redução são realizados em catalisadores contaminados com venenos redutores por meio da introdução de um agente redutor, como o hidrogênio, para restaurar sua atividade. Por exemplo, um catalisador de paládio envenenado por sulfeto pode ser tratado com um tratamento de redução sob uma atmosfera de hidrogênio para converter o sulfeto de paládio na superfície em paládio metálico e gás sulfídrico, removendo assim o veneno e restaurando a atividade do catalisador.
2. Regeneração por tratamento térmico: Remover venenos orgânicos ou depósitos de coque na superfície do catalisador por meio de torrefação em alta temperatura para restaurar a atividade do catalisador. Esse método inclui a torrefação e o tratamento de pirólise.
A torrefação em alta temperatura consiste em tratar o catalisador em altas temperaturas para remover os venenos orgânicos ou os depósitos de carbono na superfície por meio de decomposição térmica ou combustão. Por exemplo, para um catalisador envenenado por depósitos de coque, o catalisador pode ser tratado por torrefação em alta temperatura para queimar o coque na superfície, removendo assim os venenos e restaurando a atividade do catalisador. A temperatura e o tempo de torrefação precisam ser otimizados de acordo com a natureza do catalisador e o tipo de veneno para garantir a remoção eficaz do veneno sem danificar a estrutura do catalisador.
O tratamento de pirólise remove os venenos decompondo os venenos orgânicos na superfície do catalisador em produtos voláteis em altas temperaturas. Por exemplo, no caso de catalisadores envenenados por organofosfatos, o tratamento de pirólise pode ser realizado em altas temperaturas para decompor os fosfetos em produtos gasosos, removendo assim os venenos e restaurando a atividade do catalisador.
5.5 Uso de inibidores seletivos de toxicidade
A adição de co-catalisadores ao sistema de reação também pode ser eficaz para proteger os catalisadores de metais preciosos. Por exemplo, a adição de pequenas quantidades de óxidos metálicos pode adsorver ou converter substâncias tóxicas, protegendo assim a atividade do catalisador. Em sistemas de catalisador de paládio, a adição de pequenas quantidades de óxidos de lantânio (La) ou cério (Ce) pode melhorar significativamente a resistência do catalisador ao enxofre. Esses óxidos metálicos reagem com os tóxicos e impedem que eles se liguem ao catalisador de metal precioso, prolongando assim a vida útil do catalisador e mantendo sua eficiência.
5.6 Projetos avançados de catalisadores
1. Catalisadores Core-Shell: Os catalisadores core-shell são um projeto de catalisador no qual o núcleo de metal ativo é encapsulado em uma camada de casca estável. Um catalisador core-shell consiste em um núcleo (metal ativo) e um invólucro (camada protetora). O invólucro geralmente é feito de um material estável com boa resistência à toxicidade, como óxidos de sílica mesoporosa, materiais de carbono ou alumina. O material do invólucro permite que os reagentes alcancem os locais ativos do núcleo, projetando canais e tamanhos de poros adequados e bloqueando a entrada de venenos macromoleculares. Esse projeto estrutural permite que o núcleo de metal ativo passe apenas por microporos ou nanocanais quando entra em contato com os reagentes, evitando assim que os venenos entrem em contato direto e sejam adsorvidos na superfície do metal ativo. No caso do paládio (Pd), por exemplo, os catalisadores nos quais o núcleo de paládio é encapsulado por óxidos de silício mesoporosos (SiO2) podem ser significativamente mais resistentes à toxicidade. Nessa estrutura, o núcleo de paládio proporciona uma atividade catalítica eficiente, enquanto a camada de casca deSiO2 mesoporosa, por meio de sua seletividade de tamanho de poro, permite que reagentes de moléculas pequenas entrem e reajam com o núcleo de paládio, ao mesmo tempo em que bloqueia venenos de moléculas grandes, evitando, assim, o envenenamento do núcleo de paládio.
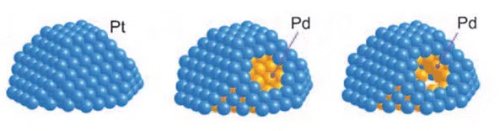
Fig. 11 A estrutura do catalisador de casca central de Pt-Pd
2. Catalisadores monoatômicos: Os catalisadores monoatômicos são produzidos pela alta dispersão dos átomos de metal ativo na superfície do transportador, de modo que cada sítio ativo seja um único átomo. Essa estrutura altamente dispersa maximiza o uso de átomos de metal e aumenta significativamente a atividade e a seletividade do catalisador. Ao mesmo tempo, como cada átomo de metal existe independentemente, é difícil que os venenos se agreguem em sua superfície, reduzindo assim o risco de envenenamento do catalisador. Por exemplo, os catalisadores de paládio de átomo único podem ser altamente dispersos em suportes de carbono dopados com nitrogênio. Cada átomo de paládio é estabilizado nos locais dopados com nitrogênio por meio de fortes interações, e esse design não apenas aumenta a atividade catalítica, mas também melhora significativamente a resistência do catalisador a venenos. Como é difícil para os venenos se agregarem em torno de átomos individuais de paládio, o catalisador é significativamente mais resistente à toxicidade.
5.7 Processos catalíticos verdes
As seguintes medidas específicas podem ser adotadas para reduzir o problema de toxicidade dos catalisadores convencionais. Em primeiro lugar, use solventes ecologicamente corretos, como solventes verdes, como água ouCO₂supercrítico, em vez de solventes orgânicos tóxicos, para reduzir o efeito de envenenamento dos venenos no catalisador. Isso não só ajuda a aumentar a segurança da reação, mas também reduz a poluição ambiental. Em segundo lugar, novos sistemas catalíticos são desenvolvidos, como a pesquisa e o desenvolvimento de tecnologias emergentes, como a catálise enzimática ou a fotocatálise. A catálise enzimática realiza reações químicas verdes por meio da alta seletividade e eficiência das enzimas biológicas, enquanto a fotocatálise usa a energia da luz para conduzir o processo de reação e evita o problema de envenenamento dos catalisadores tradicionais. Essas abordagens inovadoras não apenas melhoram a eficiência da reação, mas também reduzem o impacto negativo sobre o meio ambiente e a saúde.
6 Conclusão
Os catalisadores de metais preciosos têm uma função insubstituível no setor químico, na conversão de energia e na proteção ambiental devido ao seu desempenho catalítico eficiente e à ampla gama de aplicações. No entanto, a toxicidade dos catalisadores limita severamente sua operação estável de longo prazo e os efeitos de sua aplicação. Por meio de um estudo aprofundado do mecanismo dos catalisadores de metais preciosos e das causas do fenômeno de envenenamento, podemos tomar várias medidas para melhorar a capacidade de combate ao envenenamento e a vida útil dos catalisadores.
Em primeiro lugar, a modificação do catalisador, como a modificação da liga e da superfície, pode melhorar significativamente o desempenho antiveneno dos catalisadores. Em segundo lugar, o pré-tratamento da matéria-prima e a otimização das condições de reação podem reduzir efetivamente a geração e a adsorção de tóxicos. Além disso, a regeneração do catalisador e o uso de inibidores seletivos de tóxicos podem ajudar a restaurar e manter a atividade do catalisador. Projetos avançados de catalisadores, como catalisadores estruturados com núcleo de concha e catalisadores de átomo único, oferecem novos caminhos para o combate ao envenenamento. Por fim, a aplicação de processos catalíticos verdes não só contribui para a redução dos problemas de toxicidade, mas também promove o processo de desenvolvimento sustentável.
Concluindo, o desempenho e a vida útil dos catalisadores de metais preciosos podem ser significativamente aprimorados pela aplicação combinada dessas estratégias, atendendo, assim, à demanda por catalisadores eficientes, estáveis e ecologicamente corretos na produção industrial. Pesquisas futuras devem continuar a se dedicar ao desenvolvimento de novos catalisadores antivenenos e tecnologias catalíticas verdes para promover ainda mais a ampla aplicação de catalisadores de metais preciosos em vários campos.
Leitura relacionada:
Aplicações de catalisadores de metais preciosos: Powder vs. Pellet Insights
Referências:
[1] Qin T, Li N, Ma H, et al. Efeitos dos metais do Grupo VIII na pirólise de lignito e gaseificação de carvão com catalisador à base de Ca [J]. Fuel,2024,372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Catalisadores de Ni-Co/Mg (Al)O promovidos por metais nobres (Pt, Pd e Rh) para reforma a vapor de impurezas de alcatrão da gaseificação de biomassa[J]. Journal of Catalysis,2024,436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilization of fresh and aged simulated pyrolysis oil through mild hydrotreatment using noble metal catalysts[J]. Energy Conversion and Management,2024,313.
[4] Li L, Chen T, Zhang L, et al. Progresso recente de nanomateriais à base de Ni como promotor para melhorar o desempenho da reação de evolução de hidrogênio de catalisadores de metais nobres [J]. Journal of Alloys and Compounds,2024,998.
[5] Yun W, Rui Y, Qiang Z, et al. Nanocristais de La-RuO2 com atividade eletrocatalítica eficiente para a separação geral de água em meio ácido: Efeito sinérgico da dopagem de La e da vacância de oxigênio [J]. Chemical Engineering Journal,2022,439.

 Barras
Barras
 Miçangas e esferas
Miçangas e esferas
 Parafusos e porcas
Parafusos e porcas
 Cadinhos
Cadinhos
 Discos
Discos
 Fibras e tecidos
Fibras e tecidos
 Filmes
Filmes
 Flocos
Flocos
 Espumas
Espumas
 Folha de alumínio
Folha de alumínio
 Grânulos
Grânulos
 Favos de mel
Favos de mel
 Tinta
Tinta
 Laminado
Laminado
 Nódulos
Nódulos
 Malhas
Malhas
 Filme metalizado
Filme metalizado
 Placa
Placa
 Pós
Pós
 Vara
Vara
 Folhas
Folhas
 Cristais individuais
Cristais individuais
 Alvo de pulverização
Alvo de pulverização
 Tubos
Tubos
 Lavadora
Lavadora
 Fios
Fios
 Conversores e calculadoras
Conversores e calculadoras
 Escreva para nós
Escreva para nós
 Chin Trento
Chin Trento



