Catalisadores de metais preciosos: O amplificador de desempenho - O suporte
Capítulo 1: Introdução
Um catalisador de metal precioso é um material que pode alterar a taxa de uma reação química sem ser consumido nos produtos finais. Embora quase todos os metais preciosos possam servir como catalisadores, os mais usados são a platina, o paládio, o ródio, a prata e o rutênio, sendo que a platina e o ródio têm as aplicações mais amplas. Seus orbitais de elétrons d parcialmente preenchidos adsorvem prontamente os reagentes na superfície com força de ligação moderada, facilitando a formação de "compostos ativos" intermediários e, assim, garantindo alta atividade catalítica. Juntamente com propriedades superiores, como alta temperatura, oxidação e resistência à corrosão, eles se tornaram um dos materiais catalíticos mais importantes.
Os catalisadores de metais preciosos são indispensáveis em vários campos importantes devido à sua excepcional atividade catalítica e seletividade. Na remediação ambiental, eles são amplamente usados em sistemas de purificação de escapamento automotivo e em processos de combustão industrial para converter eficientemente poluentes tóxicos, como monóxido de carbono, óxidos de nitrogênio e compostos orgânicos voláteis, em gases inofensivos, reduzindo significativamente as emissões. Eles também desempenham papéis vitais em outras áreas de proteção ambiental, como a purificação do ar e o tratamento de águas residuais. Na produção industrial, eles são fundamentais para a síntese química, aumentando as taxas de reação e a seletividade do produto por meio de reações catalisadas, como hidrogenação, oxidação e carbonilação. Além disso, no setor de energia de ponta, os catalisadores de metais preciosos são a base das tecnologias de energia de hidrogênio, essenciais para a produção de hidrogênio, a operação de células de combustível e o armazenamento de hidrogênio, avançando assim na conversão e na utilização de energia limpa.
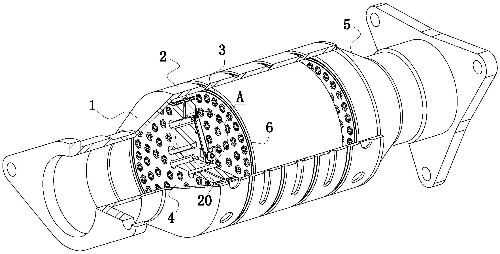
Fig. 1 Diagrama estrutural do conversor catalítico automotivo de três vias
No entanto, as desvantagens inerentes aos metais preciosos - sua escassez global, alto custo e suscetibilidade à desativação por sinterização, lixiviação e envenenamento - restringem seriamente sua aplicação comercial em larga escala. A chave para enfrentar esses desafios não está nos metais preciosos em si, mas em sua "base" - o suporte. A ciência catalítica moderna revela que o suporte está longe de ser um suporte físico inerte; ele é uma plataforma multifuncional e um parceiro sinérgico crucial para superar as limitações dos metais preciosos. Seu valor central se manifesta em dois aspectos principais:
O suporte, com sua alta área de superfície específica e abundantes defeitos de superfície, fornece "locais de ancoragem" seguros para nanopartículas de metais preciosos ou até mesmo átomos individuais, permitindo a dispersão em nível atômico. Isso não apenas maximiza a exposição dos locais ativos, melhorando significativamente a eficiência da utilização atômica, mas também evita a migração e a aglomeração (sinterização) de partículas em altas temperaturas por meio de restrições físicas espaciais e fortes interações, aumentando fundamentalmente a estabilidade do catalisador.
Existem interações profundas entre o suporte e o metal precioso. Por meio de efeitos eletrônicos (por exemplo, fortes interações metal-suporte, SMSI), o suporte pode modular a densidade da nuvem de elétrons do metal precioso, otimizando sua força de adsorção para reagentes, aumentando assim a atividade catalítica intrínseca e a seletividade. Além disso, a acidez/basicidade inerente da superfície ou as propriedades redox do suporte podem catalisar sinergicamente as reações com os locais ativos do metal precioso, possibilitando vias de reação complexas inatingíveis por componentes únicos, criando coletivamente sistemas catalíticos bifuncionais eficientes.
Capítulo 2: Funções e mecanismos principais do suporte
No projeto de catalisadores de metais preciosos, o suporte não é apenas um recipiente de reação passivo, mas um componente essencial que desempenha várias funções ativas. Seus mecanismos funcionais influenciam profundamente o desempenho final do catalisador, evidenciando-se principalmente em quatro áreas:
1. Dispersão e estabilização
A principal função do suporte é atuar como uma "ancoragem" para nanopartículas de metais preciosos. Uma área de superfície específica alta (por exemplo, centenas de m2/g) fornece vários locais de carga, permitindo que o metal precioso seja altamente disperso em nanoescala ou até mesmo em nível atômico, maximizando assim a exposição dos locais ativos e melhorando a eficiência da utilização atômica. Sem suporte, as nanopartículas de metais preciosos, devido à sua alta energia de superfície, migram prontamente, aglomeram-se e sinterizam-se em temperaturas elevadas, resultando em uma redução drástica da área de superfície ativa e na desativação. Além disso, as estruturas de poros de muitos suportes podem criar um efeito de confinamento, restringindo as partículas de metal dentro de nanocavidades ou intercamadas, como a criação de "nanorreatores", o que impede fisicamente seu movimento e crescimento, aumentando ainda mais a estabilidade térmica.

Fig. 2 Materiais porosos
2. Efeitos eletrônicos
Existem interações eletrônicas profundas entre o suporte e o metal precioso, principalmente a Interação Forte Metal-Suporte (SMSI). Usando o sistema Pt/TiO2 como exemplo, após o tratamento de redução em alta temperatura, parte do Ti4+ na superfície do TiO2 é reduzida e migra para cobrir a superfície das nanopartículas de Pt, formando uma camada de subóxido. Esse processo é acompanhado pela transferência de elétrons do TiO2 para a Pt, alterando a densidade da nuvem de elétrons da Pt e, consequentemente, modulando sua força e modo de adsorção para moléculas reagentes (por exemplo, CO, O2). Esse "controle remoto" por meio de efeitos eletrônicos pode aumentar significativamente a atividade catalítica e a seletividade de reações específicas e até mesmo conferir resistência ao envenenamento.
3. Catálise sinérgica
Muitos suportes não são inertes; suas superfícies possuem sítios ácidos/básicos ou sítios cataliticamente ativos inerentes, permitindo a catálise sinérgica com o metal precioso, constituindo um mecanismo "bifuncional". Por exemplo, na reforma catalítica do refino de petróleo, a Pt no catalisador Pt/γ-Al2O3 é responsável pela hidrogenação/desidrogenação de olefinas, enquanto os locais ácidos na superfície do γ-Al2O3 facilitam a isomerização de carbocátions; as duas funções trabalham juntas para reconstruir as moléculas de hidrocarbonetos. Outro exemplo está nas reações de ânodo de célula de combustível, em que as espécies de RuOH em catalisadores PtRu/C promovem a ativação da água, fornecendo espécies de OH aos locais adjacentes de Pt para oxidar o CO, resolvendo o problema do envenenamento do catalisador de Pt pelo CO.
Fig. 3 Catálise cooperativa de metal/molécula pequena orgânica
4. Transferência de massa e calor
A estrutura física do suporte determina a eficiência do transporte de reagentes e produtos. O ajuste preciso da estrutura porosa (incluindo o tamanho, o volume e a conectividade dos poros) otimiza as taxas de difusão, evitando perdas na eficiência da reação devido a limitações na transferência de massa. Os macroporos favorecem a rápida transferência de massa, os mesoporos são adequados para carregar nanopartículas e facilitar as reações, e os microporos podem permitir a seletividade da forma. Simultaneamente, excelentes suportes possuem alta estabilidade térmica e condutividade térmica, o que lhes permite suportar ambientes de reação exotérmica de alta temperatura, remover rapidamente o calor da reação e evitar o colapso da estrutura do catalisador e a sinterização do componente ativo causados pelo superaquecimento local.
Capítulo 3: Principais tipos de suportes para catalisadores de metais preciosos e suas características
1. Suportes de óxido
Os suportes de óxido são a categoria mais extensivamente estudada e amplamente aplicada.
γ-Al2O3: Conhecido como o "suporte de trabalho", suas vantagens incluem alta área de superfície específica, acidez de superfície adequada e boa resistência mecânica. Essas propriedades o tornam ideal para catalisadores automotivos de três vias (carga de Pt, Pd, Rh) e catalisadores de hidrodessulfurização (carga de Pd).
SiO2: Normalmente, possui uma superfície neutra e uma área de superfície específica alta. Sua inércia superficial significa que não interfere na atividade intrínseca do metal precioso. O SiO2 mesoporoso sintonizável pode ser preparado por meio de métodos de modelagem, encontrando amplo uso em reações seletivas de hidrogenação e oxidação.
TiO2: Além de sua alta área de superfície específica, sua característica mais significativa é a capacidade de formar fortes interações metal-suporte (SMSI) com metais preciosos, aumentando consideravelmente o desempenho catalítico. Ao mesmo tempo, o TiO2 é um excelente semicondutor fotossensível; quando combinado com Au, Pt, etc., apresenta grande potencial em fotocatálise para a divisão de água e degradação de poluentes.
CeO2: Possui capacidade exclusiva de armazenamento de oxigênio (OSC), o que lhe permite alternar rapidamente entre atmosferas oxidantes e redutoras por meio do ciclo Ce4+/Ce3+, regulando com eficiência a concentração de oxigênio no ambiente de reação. Essa característica o torna indispensável na purificação de escapamentos automotivos (como co-catalisador) e em reações relacionadas a redox.
Tabela 1: Comparação das principais características do suporte de óxido
|
Tipo de suporte |
Área de superfície específica |
Propriedade da superfície |
Principais características |
Aplicações típicas |
|
γ-Al2O3 |
Alta |
Fracamente ácido |
Alta resistência mecânica, boa estabilidade térmica |
Limpeza de escapamento de automóveis, hidrotratamento |
|
SiO2 |
Alta |
Neutro |
Tamanho de poro ajustável, superfície inerte |
Hidrogenação seletiva, oxidação |
|
TiO2 |
Médio |
Anfotérico |
SMSI, atividade fotocatalítica |
Fotocatálise, oxidação de CO |
|
CeO2 |
Médio |
Básico |
Excelente capacidade de armazenamento de oxigênio |
Catalisadores de três vias, reação de deslocamento de água e gás |
2. Suportes de materiais de carbono
Os materiais de carbono são notáveis por sua condutividade e diversidade estrutural.
Carbono ativado: Apresenta uma área de superfície específica extremamente alta e grupos funcionais de superfície abundantes (por exemplo, -OH, -COOH), o que facilita a modificação e o carregamento de metais. Devido ao seu baixo custo, é amplamente utilizado em reações em fase líquida (por exemplo, hidrogenação química fina) e eletrocatálise.
Nanotubos de carbono/Grafeno: esses novos materiais de carbono possuem uma estrutura de carbono hibridizada sp² exclusiva, condutividade extremamente alta e canais de poros regulares. Eles não apenas induzem efeitos eletrônicos com metais preciosos por meio da conjugação π-π, mas também garantem a rápida transferência de elétrons durante a eletrocatálise devido à sua excepcional condutividade, demonstrando, assim, um excelente desempenho em áreas como células de combustível (por exemplo, Pt/CNTs para redução de oxigênio) e eletrólise da água.
3. Suportes de zeólita
As zeólitas são aluminossilicatos cristalinos caracterizados principalmente por seus sistemas de canais microporosos ordenados e acidez ajustável.
Seletividade de forma: Seus tamanhos de poros em escala molecular (normalmente <2 nm) permitem a passagem seletiva de reagentes e produtos com base no tamanho e na forma, possibilitando a catálise seletiva de forma. Por exemplo, no hidrofinamento de diesel catalisado por Pt/zeólita, os alcenos de cadeia linear podem ser hidrogenados seletivamente, enquanto os alcanos ramificados são retidos.
Forte acidez e efeito de confinamento: Seus fortes centros ácidos, combinados com o confinamento de partículas metálicas em microporos, fazem com que eles sejam excelentes em reações como isomerização e aromatização de alcanos.
4. Outros suportes novos
Com os avanços na nanotecnologia, uma gama de novos suportes apresenta grande potencial.
Estruturas metal-orgânicas (MOFs): Compostas por íons metálicos e ligantes orgânicos, elas apresentam uma área de superfície específica ultra-alta e ambientes de poros atomicamente projetáveis, o que as torna plataformas ideais para alcançar a dispersão de um único átomo de metais preciosos e a catálise seletiva por tamanho
Materiais mesoporosos: Como o SBA-15 e o MCM-41, apresentam estruturas mesoporosas altamente ordenadas e distribuições estreitas de tamanho de poros, proporcionando canais ideais para a transferência de massa e reações de moléculas grandes, abordando os problemas de transferência de massa lenta dos materiais microporosos.
Carbetos/Nitretos: Como o carbeto de molibdênio e o nitreto de carbono, eles apresentam condutividade semelhante à do metal, alta estabilidade química e estabilidade térmica. Como suportes de eletrocatalisadores emergentes ou catalisadores sinérgicos, eles apresentam potencial para substituir os suportes tradicionais.
Tabela 2: Comparação de outras características do tipo de suporte
|
Tipo de suporte |
Característica estrutural |
Vantagem principal |
Aplicações potenciais |
|
Zeólitos |
Microporoso cristalino |
Seletividade de forma, forte acidez |
Hidrogenação seletiva de forma, isomerização, peneiramento molecular |
|
MOFs |
Porosos cristalinos |
Área de superfície ultra-alta, estrutura projetável |
Catálise de átomo único, armazenamento/separação de gás |
|
Materiais mesoporosos |
Mesoporos ordenados |
Tamanho uniforme dos poros, alta eficiência de transferência de massa |
Catálise de moléculas grandes, biossensor |
|
Carbetos/Nitretos |
Compostos intersticiais |
Alta condutividade, alta estabilidade |
Eletrocatálise, catálise resistente à corrosão |
Capítulo 5: Desafios e perspectivas futuras
Os catalisadores de metais preciosos, embora indispensáveis, enfrentam obstáculos significativos que impulsionam as pesquisas em andamento. O principal desafio continua sendo seu alto custo e sua escassez natural, o que cria vulnerabilidades econômicas e na cadeia de suprimentos para aplicações em larga escala, como catálise automotiva e produção de produtos químicos em massa. Isso é agravado por sua tendência inerente de desativação, principalmente por meio de sinterização - em que as nanopartículas se aglomeram em partículas maiores e menos ativas em temperaturas elevadas - e por envenenamento por subprodutos da reação. Além disso, o desempenho desses catalisadores geralmente é limitado por materiais de suporte tradicionais que funcionam apenas como suportes passivos, não conseguindo aprimorar ou estabilizar ativamente o metal precioso. Um desafio científico mais profundo está na compreensão incompleta das mudanças dinâmicas nos locais ativos em condições reais de operação e nas relações precisas entre estrutura e atividade, o que dificulta o projeto racional.
O progresso futuro está intimamente ligado a estratégias inovadoras que maximizam a eficiência e a durabilidade. Um foco central é a maximização da eficiência da utilização atômica. Isso envolve ir além da simples dispersão de nanopartículas para arquiteturas avançadas, como os catalisadores de átomo único (SACs), que teoricamente podem atingir 100% de dispersão de metal, e estruturas sofisticadas de núcleos ou nanoestruturas que concentram átomos preciosos na superfície onde ocorrem as reações. A estratégia "Atom-Extraction", por exemplo, demonstra como o design da liga pode ser usado para puxar átomos de metais preciosos do núcleo de uma nanopartícula para sua superfície, aumentando consideravelmente a eficiência e minimizando a carga.
Ao mesmo tempo, a função do suporte está sendo redefinida, passando de um espectador passivo para um parceiro ativo e sinérgico. O futuro está no design inteligente do suporte, capaz de controlar eletrônica e geometricamente com precisão. Isso inclui a engenharia de fortes interações metal-suporte (SMSI) para otimizar as propriedades eletrônicas e o uso de novos materiais, como estruturas metal-orgânicas (MOFs) ou hidróxidos duplos em camadas 2D (LDHs), que oferecem ambientes atomicamente definidos para estabilizar os átomos de metal. O conceito de efeitos de confinamento, em que as partículas de metal ficam fisicamente presas em estruturas porosas, é uma abordagem poderosa para evitar a sinterização.
O paradigma de desenvolvimento está mudando da descoberta empírica para o design racional. A integração do aprendizado de máquina, da computação de alto rendimento e da caracterização avançada in situ está acelerando a descoberta de novos materiais e nossa compreensão dos mecanismos catalíticos. Juntamente com a otimização do uso de metais preciosos, a busca de longo prazo por catalisadores com baixo teor de PGM (metais do grupo da platina) e, em última análise, sem PGM, com base em metais de transição abundantes na terra, continua sendo um caminho essencial, embora desafiador, para a catálise sustentável. Esses esforços combinados visam a romper as tradicionais compensações entre atividade, estabilidade e custo.

Fig. 4 Nanotecnologia do futuro
Capítulo 6: Conclusão
Em resumo, o suporte desempenha várias funções em catalisadores de metais preciosos que vão muito além da mera estrutura física. Ele é a pedra angular para alcançar alta dispersão, alta estabilidade e alta eficiência de utilização de metais preciosos, e é fundamental para melhorar ativamente o desempenho catalítico por meio de efeitos eletrônicos e sinérgicos. Ao enfrentar os principais desafios da escassez e da instabilidade dos metais preciosos, a direção futura é clara: uma mudança da triagem empírica tradicional para um projeto racional preciso. Ao construir catalisadores de um único átomo, estruturas de núcleo-casca e desenvolver novos suportes multifuncionais, podemos "decorar primorosamente" metais preciosos em escala atômica/nanométrica. Em última análise, isso nos permitirá reduzir drasticamente o uso de metais preciosos e, ao mesmo tempo, aprimorar multiplicativamente o desempenho catalítico e a vida útil, fornecendo a principal força motriz para o desenvolvimento sustentável nos setores de energia, meio ambiente e químico.
Para obter soluções avançadas de catalisadores de metais preciosos que atendam a essas demandas em evolução, entre em contato com a Stanford Advanced Materials (SAM).
Leitura relacionada:
Catalysis Redefined (Catálise redefinida): Vantagens do paládio sobre carbono
Referências:
[1] Bell, A. T. (2003). The Impact of Nanoscience on Heterogeneous Catalysis (O impacto da nanociência na catálise heterogênea). Science, 299(5613), 1688-1691.
[2] Somorjai, G. A., & Li, Y. (2010). Introduction to Surface Chemistry and Catalysis (Introdução à Química de Superfície e Catálise). Wiley.
[3] Tauster, S. J., Fung, S. C., & Garten, R. L. (1978). Strong Metal-Support Interactions. Metais Nobres do Grupo 8 com Suporte em TiO2. Journal of the American Chemical Society, *100*(1), 170-175.
[4] Cargnello, M., et al. (2013). Control of Metal Nanocrystal Size Reveals Metal-Support Interface Role for Ceria Catalysts (Controle do tamanho dos nanocristais de metal revela a função da interface metal-suporte para catalisadores de céria). Science, 341(6147), 771-773.

 Barras
Barras
 Miçangas e esferas
Miçangas e esferas
 Parafusos e porcas
Parafusos e porcas
 Cadinhos
Cadinhos
 Discos
Discos
 Fibras e tecidos
Fibras e tecidos
 Filmes
Filmes
 Flocos
Flocos
 Espumas
Espumas
 Folha de alumínio
Folha de alumínio
 Grânulos
Grânulos
 Favos de mel
Favos de mel
 Tinta
Tinta
 Laminado
Laminado
 Nódulos
Nódulos
 Malhas
Malhas
 Filme metalizado
Filme metalizado
 Placa
Placa
 Pós
Pós
 Vara
Vara
 Folhas
Folhas
 Cristais individuais
Cristais individuais
 Alvo de pulverização
Alvo de pulverização
 Tubos
Tubos
 Lavadora
Lavadora
 Fios
Fios
 Conversores e calculadoras
Conversores e calculadoras
 Escreva para nós
Escreva para nós
 Dr. Samuel R. Matthews
Dr. Samuel R. Matthews


